
°ĺŐ‚ńŅ°Ņ![]() ĺŖ”–ł∆Ó—Ņů–ÕĹŠĻĻ£¨“ÚĺŖ”–”Ň“žĶńĶÁľęĽĮŐō–‘°ĘŐķīŇ–‘°Ę∑«īŇĺÝ‘Ķ–‘Ķ»∂ÝĪł ‹Ļō◊Ę°£ĽōīūŌ¬Ń–ő Ő‚£ļ
ĺŖ”–ł∆Ó—Ņů–ÕĹŠĻĻ£¨“ÚĺŖ”–”Ň“žĶńĶÁľęĽĮŐō–‘°ĘŐķīŇ–‘°Ę∑«īŇĺÝ‘Ķ–‘Ķ»∂ÝĪł ‹Ļō◊Ę°£ĽōīūŌ¬Ń–ő Ő‚£ļ
![]() Ō¬Ń–F‘≠◊”ĻžĶņĪŪīÔ ĹňýĪŪ ĺĶń◊īŐ¨£¨ń‹ŃŅ”…łŖĶĹĶÕĶńň≥–Ú’ż»∑Ķń «_______
Ō¬Ń–F‘≠◊”ĻžĶņĪŪīÔ ĹňýĪŪ ĺĶń◊īŐ¨£¨ń‹ŃŅ”…łŖĶĹĶÕĶńň≥–Ú’ż»∑Ķń «_______![]() ŐÓ—°ŌÓ◊÷ńł
ŐÓ—°ŌÓ◊÷ńł![]() °£
°£
![]()
A.![]()
![]()
![]()
![]()
![]() ŌŗÕ¨—Ļ«ŅŌ¬£¨HF°ĘHCl°ĘHBrĶń∑–Ķ„”…łŖĶĹĶÕĶńň≥–Úő™_________£¨‘≠“Úő™_______°£
ŌŗÕ¨—Ļ«ŅŌ¬£¨HF°ĘHCl°ĘHBrĶń∑–Ķ„”…łŖĶĹĶÕĶńň≥–Úő™_________£¨‘≠“Úő™_______°£
![]() ‘™ňōŅ…–ő≥…∂ŗ÷÷÷ō“™ĽĮļŌőÔ£¨»Á
‘™ňōŅ…–ő≥…∂ŗ÷÷÷ō“™ĽĮļŌőÔ£¨»Á![]() °Ę
°Ę![]() °Ę
°Ę![]() Ķ»°£∆š÷–
Ķ»°£∆š÷–![]() ĶńVSEPRń£–Õő™_____________£Ľ
ĶńVSEPRń£–Õő™_____________£Ľ![]() ÷–N‘≠◊”Ķń‘”ĽĮ–ő Ĺő™__________£Ľ
÷–N‘≠◊”Ķń‘”ĽĮ–ő Ĺő™__________£Ľ![]() ÷–
÷–![]() ľŁ”Ž
ľŁ”Ž![]() ľŁĶń żńŅ÷ģĪ»ő™_________°£
ľŁĶń żńŅ÷ģĪ»ő™_________°£
![]() ◊ť≥…
◊ť≥…![]() Ķń‘≠◊”ĶńĶŕ“ĽĶÁņŽń‹”…–°ĶĹīůĶńň≥–Úő™___________
Ķń‘≠◊”ĶńĶŕ“ĽĶÁņŽń‹”…–°ĶĹīůĶńň≥–Úő™___________![]() ”√‘™ňō∑ŻļŇĪŪ ĺ
”√‘™ňō∑ŻļŇĪŪ ĺ![]() £Ľ∆š÷–»ż÷÷‘≠◊”ĽýŐ¨ Īňýļ¨őī≥…∂‘ĶÁ◊” ż◊Ó∂ŗĶń «_________
£Ľ∆š÷–»ż÷÷‘≠◊”ĽýŐ¨ Īňýļ¨őī≥…∂‘ĶÁ◊” ż◊Ó∂ŗĶń «_________![]() ŐÓ‘™ňō∑ŻļŇ
ŐÓ‘™ňō∑ŻļŇ![]() °£
°£
![]() ĶńŃĘ∑ĹĺßįŻĹŠĻĻ»ÁÕľňý ĺ£¨∆š÷–
ĶńŃĘ∑ĹĺßįŻĹŠĻĻ»ÁÕľňý ĺ£¨∆š÷–![]() ≤…”√ľÚĶ•ŃĘ∑Ĺ∂—Ľż°£
≤…”√ľÚĶ•ŃĘ∑Ĺ∂—Ľż°£

![]() ”Ž
”Ž![]() ĹŰŃŕĶńF‘≠◊”łŲ żő™__________°£
ĹŰŃŕĶńF‘≠◊”łŲ żő™__________°£
![]() »ŰĺßįŻ≤ő żő™
»ŰĺßįŻ≤ő żő™![]() £¨įĘ∑Łľ”Ķ¬¬ř≥£ żĶń÷Ķő™
£¨įĘ∑Łľ”Ķ¬¬ř≥£ żĶń÷Ķő™![]() £¨‘ÚĺßŐŚ√‹∂»ő™_______
£¨‘ÚĺßŐŚ√‹∂»ő™_______![]() ”√ļ¨a°Ę
”√ļ¨a°Ę![]() Ķńīķ ż ĹĪŪ ĺ
Ķńīķ ż ĹĪŪ ĺ![]() °£
°£
°ĺīūįł°Ņ![]()
![]() HF∑÷◊”ľšń‹–ő≥…«‚ľŁ£¨HBrĪ»HClĶńŌŗ∂‘∑÷◊”÷ ŃŅīů£¨∑÷◊”ľš◊ų”√Ѷīů ňń√śŐŚ–ő
HF∑÷◊”ľšń‹–ő≥…«‚ľŁ£¨HBrĪ»HClĶńŌŗ∂‘∑÷◊”÷ ŃŅīů£¨∑÷◊”ľš◊ų”√Ѷīů ňń√śŐŚ–ő ![]()
![]()
![]() Co
Co ![]()
![]()
°ĺĹ‚őŲ°Ņ
![]() ļÕ
ļÕ![]() ĺýő™ĽýŐ¨F‘≠◊”ĶńĻžĶņĪŪīÔ Ĺ£¨
ĺýő™ĽýŐ¨F‘≠◊”ĶńĻžĶņĪŪīÔ Ĺ£¨![]() ő™1łŲ1sĶÁ◊”‘ĺ«®ĶĹ3pń‹ľ∂£¨
ő™1łŲ1sĶÁ◊”‘ĺ«®ĶĹ3pń‹ľ∂£¨![]() ő™1łŲ2sĶÁ◊”‘ĺ«®ĶĹ3sń‹ľ∂£Ľ
ő™1łŲ2sĶÁ◊”‘ĺ«®ĶĹ3sń‹ľ∂£Ľ
![]() HF∑÷◊”ľšń‹–ő≥…«‚ľŁ£¨∆š∑–Ķ„Ōŗ∂‘∆šňŻ¬ĪĽĮ«‚“™łŖ£¨HBrĪ»HClĶńŌŗ∂‘∑÷◊”÷ ŃŅīů£¨∑÷◊”ľš◊ų”√Ѷīů£¨ňý“‘HBrĶń∑–Ķ„ĹŌłŖ£Ľ
HF∑÷◊”ľšń‹–ő≥…«‚ľŁ£¨∆š∑–Ķ„Ōŗ∂‘∆šňŻ¬ĪĽĮ«‚“™łŖ£¨HBrĪ»HClĶńŌŗ∂‘∑÷◊”÷ ŃŅīů£¨∑÷◊”ľš◊ų”√Ѷīů£¨ňý“‘HBrĶń∑–Ķ„ĹŌłŖ£Ľ
![]() ÷–O‘≠◊”ĶńľŘ≤„ĶÁ◊”∂‘ żńŅő™4£Ľ
÷–O‘≠◊”ĶńľŘ≤„ĶÁ◊”∂‘ żńŅő™4£Ľ![]() ÷–N‘≠◊”ĶńľŘ≤„ĶÁ◊”∂‘ żő™4£Ľ
÷–N‘≠◊”ĶńľŘ≤„ĶÁ◊”∂‘ żő™4£Ľ![]() ĶńĹŠĻĻ Ĺő™
ĶńĹŠĻĻ Ĺő™ £Ľ
£Ľ
![]() ÷–F‘™ňōĶń∑«Ĺū Ű–‘◊Ó«Ņ£¨K‘™ňōĶńĹū Ű–‘◊Ó«Ņ£ĽĽýŐ¨K‘≠◊”Ķńőī≥…∂‘ĶÁ◊” żő™1£¨ĽýŐ¨Co‘≠◊”Ķńőī≥…∂‘ĶÁ◊” żő™3£¨ĽýŐ¨F‘≠◊”Ķńőī≥…∂‘ĶÁ◊” żő™1£Ľ
÷–F‘™ňōĶń∑«Ĺū Ű–‘◊Ó«Ņ£¨K‘™ňōĶńĹū Ű–‘◊Ó«Ņ£ĽĽýŐ¨K‘≠◊”Ķńőī≥…∂‘ĶÁ◊” żő™1£¨ĽýŐ¨Co‘≠◊”Ķńőī≥…∂‘ĶÁ◊” żő™3£¨ĽýŐ¨F‘≠◊”Ķńőī≥…∂‘ĶÁ◊” żő™1£Ľ
![]() ”…ĺßįŻĹŠĻĻÕľ÷™£¨
”…ĺßįŻĹŠĻĻÕľ÷™£¨![]() ī¶”ŕĺßįŻ∂•Ķ„őĽ÷√£¨F‘≠◊”ī¶”ŕĺßįŻ√ś–ńőĽ÷√£Ľ
ī¶”ŕĺßįŻ∂•Ķ„őĽ÷√£¨F‘≠◊”ī¶”ŕĺßįŻ√ś–ńőĽ÷√£Ľ
![]() Ō»»∑∂®ĺßįŻĶń◊ť≥…£¨‘Ŕ»∑∂®ĺßįŻĶń÷ ŃŅ£¨‘ŔĹŠļŌ√‹∂»
Ō»»∑∂®ĺßįŻĶń◊ť≥…£¨‘Ŕ»∑∂®ĺßįŻĶń÷ ŃŅ£¨‘ŔĹŠļŌ√‹∂»![]() ľ∆ň„°£
ľ∆ň„°£
![]() ļÕ
ļÕ![]() ĺýő™ĽýŐ¨F‘≠◊”ĶńĻžĶņĪŪīÔ Ĺ£¨
ĺýő™ĽýŐ¨F‘≠◊”ĶńĻžĶņĪŪīÔ Ĺ£¨![]() ő™1łŲ1sĶÁ◊”‘ĺ«®ĶĹ3pń‹ľ∂£¨
ő™1łŲ1sĶÁ◊”‘ĺ«®ĶĹ3pń‹ľ∂£¨![]() ő™1łŲ2sĶÁ◊”‘ĺ«®ĶĹ3sń‹ľ∂£¨Ļ
ő™1łŲ2sĶÁ◊”‘ĺ«®ĶĹ3sń‹ľ∂£¨Ļ ![]() Ī»
Ī»![]() ń‹ŃŅłŖ£¨
ń‹ŃŅłŖ£¨![]() Ī»
Ī»![]() °Ę
°Ę![]() ń‹ŃŅłŖ£¨‘Úń‹ŃŅ”…łŖĶĹĶÕň≥–Úő™
ń‹ŃŅłŖ£¨‘Úń‹ŃŅ”…łŖĶĹĶÕň≥–Úő™![]() £¨Ļ īūįłő™D£Ľ
£¨Ļ īūįłő™D£Ľ
![]() HF∑÷◊”ľšń‹–ő≥…«‚ľŁ£¨∆š∑–Ķ„Ōŗ∂‘∆šňŻ¬ĪĽĮ«‚“™łŖ£¨HBrĪ»HClĶńŌŗ∂‘∑÷◊”÷ ŃŅīů£¨∑÷◊”ľš◊ų”√Ѷīů£¨ňý“‘HBrĶń∑–Ķ„ĹŌłŖ£¨ňý“‘∑–Ķ„”…łŖĶĹĶÕň≥–Úő™
HF∑÷◊”ľšń‹–ő≥…«‚ľŁ£¨∆š∑–Ķ„Ōŗ∂‘∆šňŻ¬ĪĽĮ«‚“™łŖ£¨HBrĪ»HClĶńŌŗ∂‘∑÷◊”÷ ŃŅīů£¨∑÷◊”ľš◊ų”√Ѷīů£¨ňý“‘HBrĶń∑–Ķ„ĹŌłŖ£¨ňý“‘∑–Ķ„”…łŖĶĹĶÕň≥–Úő™![]() £Ľ
£Ľ
![]() ÷–O‘≠◊”ĶńľŘ≤„ĶÁ◊”∂‘ żńŅő™4£¨VSEPRń£–Õő™ňń√śŐŚ–ő£Ľ
÷–O‘≠◊”ĶńľŘ≤„ĶÁ◊”∂‘ żńŅő™4£¨VSEPRń£–Õő™ňń√śŐŚ–ő£Ľ![]() ÷–N‘≠◊”ĶńľŘ≤„ĶÁ◊”∂‘ żő™4£¨∆š‘”ĽĮ–ő Ĺő™
÷–N‘≠◊”ĶńľŘ≤„ĶÁ◊”∂‘ żő™4£¨∆š‘”ĽĮ–ő Ĺő™![]() £Ľ
£Ľ![]() ĶńĹŠĻĻ Ĺő™
ĶńĹŠĻĻ Ĺő™ £¨∆š÷–
£¨∆š÷–![]() ľŁ”Ž
ľŁ”Ž![]() ľŁĶń żńŅ÷ģĪ»ő™5£ļ1£Ľ
ľŁĶń żńŅ÷ģĪ»ő™5£ļ1£Ľ
![]() ÷–F‘™ňōĶń∑«Ĺū Ű–‘◊Ó«Ņ£¨K‘™ňōĶńĹū Ű–‘◊Ó«Ņ£¨Ļ Ķŕ“ĽĶÁņŽń‹”…–°ĶĹīůĶńň≥–Úő™
÷–F‘™ňōĶń∑«Ĺū Ű–‘◊Ó«Ņ£¨K‘™ňōĶńĹū Ű–‘◊Ó«Ņ£¨Ļ Ķŕ“ĽĶÁņŽń‹”…–°ĶĹīůĶńň≥–Úő™![]() £ĽĽýŐ¨K‘≠◊”Ķńőī≥…∂‘ĶÁ◊” żő™1£¨ĽýŐ¨Co‘≠◊”Ķńőī≥…∂‘ĶÁ◊” żő™3£¨ĽýŐ¨F‘≠◊”Ķńőī≥…∂‘ĶÁ◊” żő™1£¨Ļ őī≥…∂‘ĶÁ◊” ż◊Ó∂ŗĶń «Co‘≠◊”£Ľ
£ĽĽýŐ¨K‘≠◊”Ķńőī≥…∂‘ĶÁ◊” żő™1£¨ĽýŐ¨Co‘≠◊”Ķńőī≥…∂‘ĶÁ◊” żő™3£¨ĽýŐ¨F‘≠◊”Ķńőī≥…∂‘ĶÁ◊” żő™1£¨Ļ őī≥…∂‘ĶÁ◊” ż◊Ó∂ŗĶń «Co‘≠◊”£Ľ
![]() ”…ĺßįŻĹŠĻĻÕľ÷™£¨
”…ĺßįŻĹŠĻĻÕľ÷™£¨![]() ī¶”ŕĺßįŻ∂•Ķ„őĽ÷√£¨F‘≠◊”ī¶”ŕĺßįŻ√ś–ńőĽ÷√£¨Ļ ”Ž
ī¶”ŕĺßįŻ∂•Ķ„őĽ÷√£¨F‘≠◊”ī¶”ŕĺßįŻ√ś–ńőĽ÷√£¨Ļ ”Ž![]() ĹŰŃŕĶńF‘≠◊”łŲ żő™12£Ľ
ĹŰŃŕĶńF‘≠◊”łŲ żő™12£Ľ
![]() ”…ĺßįŻĹŠĻĻŅ…÷™√ŅłŲĺßįŻļ¨”–1łŲ
”…ĺßįŻĹŠĻĻŅ…÷™√ŅłŲĺßįŻļ¨”–1łŲ![]() °Ę1łŲCo‘≠◊”°Ę3łŲF‘≠◊”£¨‘ÚĺßįŻĶń÷ ŃŅő™
°Ę1łŲCo‘≠◊”°Ę3łŲF‘≠◊”£¨‘ÚĺßįŻĶń÷ ŃŅő™![]() £¨Ļ ĺßŐŚ√‹∂»ő™
£¨Ļ ĺßŐŚ√‹∂»ő™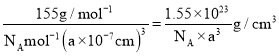 £Ľ
£Ľ



| ńÍľ∂ | łŖ÷–Ņő≥Ő | ńÍľ∂ | ≥ű÷–Ņő≥Ő |
| łŖ“Ľ | łŖ“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű“Ľ | ≥ű“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ∂Ģ | łŖ∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű∂Ģ | ≥ű∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ»ż | łŖ»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű»ż | ≥ű»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° |
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ![]() Ō¬Ń–őÔ÷ ÷–£¨ľ»ļ¨”–ľę–‘Ļ≤ľŘľŁ£¨”÷ļ¨”–∑«ľę–‘Ļ≤ľŘľŁĶń «______
Ō¬Ń–őÔ÷ ÷–£¨ľ»ļ¨”–ľę–‘Ļ≤ľŘľŁ£¨”÷ļ¨”–∑«ľę–‘Ļ≤ľŘľŁĶń «______
A.![]() B.
B.![]() C.
C.![]()
![]()
![]() ń≥ņŽ◊”ĺßŐŚĺßįŻĶńĹŠĻĻ»ÁÕľ1ňý ĺ£¨
ń≥ņŽ◊”ĺßŐŚĺßįŻĶńĹŠĻĻ»ÁÕľ1ňý ĺ£¨![]() őĽ”ŕŃĘ∑ĹŐŚ÷––ń£¨
őĽ”ŕŃĘ∑ĹŐŚ÷––ń£¨![]() őĽ”ŕŃĘ∑ĹŐŚ∂•Ķ„°£ł√ĺßŐŚĶńĽĮ—ß Ĺő™______
őĽ”ŕŃĘ∑ĹŐŚ∂•Ķ„°£ł√ĺßŐŚĶńĽĮ—ß Ĺő™______
A.![]()
![]() C.
C.![]()
![]()
![]() Ō¬Ń–őÔ÷ –‘÷ ĶńĪšĽĮĻś¬…”ŽľŁń‹őřĻōĶń «______
Ō¬Ń–őÔ÷ –‘÷ ĶńĪšĽĮĻś¬…”ŽľŁń‹őřĻōĶń «______
A.»»ő»–‘£ļ![]()
B.»Ř°Ę∑–Ķ„£ļĹūł’ Į![]() ĺßŐŚĻŤ
ĺßŐŚĻŤ
C.»ŘĶ„£ļ![]()
D.»Ř°Ę∑–Ķ„£ļ![]()
![]() °ĘS°ĘSe «Õ¨“Ľ÷ų◊Ś‘™ňō£¨«ŽĽōīūŌ¬Ń–ő Ő‚£ļ
°ĘS°ĘSe «Õ¨“Ľ÷ų◊Ś‘™ňō£¨«ŽĽōīūŌ¬Ń–ő Ő‚£ļ
![]() °ĘS°ĘSeĶńĶÁłļ–‘”…īůĶĹ–°Ķńň≥–Ú «______°£
°ĘS°ĘSeĶńĶÁłļ–‘”…īůĶĹ–°Ķńň≥–Ú «______°£
![]() «______∑÷◊”
«______∑÷◊”![]() ŐÓ°įľę–‘°ĪĽÚ°į∑«ľę–‘°Ī
ŐÓ°įľę–‘°ĪĽÚ°į∑«ľę–‘°Ī![]() £¨÷––ń‘≠◊”ĶńĻžĶņ‘”ĽĮņŗ–Õő™______£¨
£¨÷––ń‘≠◊”ĶńĻžĶņ‘”ĽĮņŗ–Õő™______£¨![]() ∑÷◊”ĶńŃĘŐŚĻĻ–Õ√Ż≥∆ «______°£
∑÷◊”ĶńŃĘŐŚĻĻ–Õ√Ż≥∆ «______°£
![]() Ķń∑–Ķ„łŖ”ŕ
Ķń∑–Ķ„łŖ”ŕ![]() Ķń∑–Ķ„£¨∆š‘≠“Ú «______°£
Ķń∑–Ķ„£¨∆š‘≠“Ú «______°£
![]() ”Ž
”Ž![]() ∑÷◊”Ľ•ő™Ķ»ĶÁ◊”ŐŚĶń“űņŽ◊”ő™______
∑÷◊”Ľ•ő™Ķ»ĶÁ◊”ŐŚĶń“űņŽ◊”ő™______![]() ŐÓĽĮ—ß Ĺ
ŐÓĽĮ—ß Ĺ![]() °£
°£
![]() “—÷™Se‘≠◊”Ī»O‘≠◊”∂ŗ2łŲĶÁ◊”≤„£¨ĽýŐ¨Se‘≠◊”ļňÕ‚ĶÁ◊”ŇŇ≤ľ Ĺő™______£¨”–______łŲőī≥…∂‘ĶÁ◊”°£
“—÷™Se‘≠◊”Ī»O‘≠◊”∂ŗ2łŲĶÁ◊”≤„£¨ĽýŐ¨Se‘≠◊”ļňÕ‚ĶÁ◊”ŇŇ≤ľ Ĺő™______£¨”–______łŲőī≥…∂‘ĶÁ◊”°£
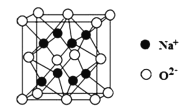
![]() ņŽĽĮļŌőÔ
ņŽĽĮļŌőÔ![]() ĶńĺßįŻ»ÁÕľňý ĺ£¨
ĶńĺßįŻ»ÁÕľňý ĺ£¨![]() ĶńŇšőĽ ż «______£Ľ»ŰįĘ∑Łľ”Ķ¬¬ř≥£ ż÷Ķő™
ĶńŇšőĽ ż «______£Ľ»ŰįĘ∑Łľ”Ķ¬¬ř≥£ ż÷Ķő™![]() £¨ĺßįŻ≤ő żő™anm£¨Ń– Ĺľ∆ň„ĺßŐŚĶń√‹∂»
£¨ĺßįŻ≤ő żő™anm£¨Ń– Ĺľ∆ň„ĺßŐŚĶń√‹∂»![]() ______
______![]() ÷ĽŃ– Ĺ£¨≤Ľ”√ľ∆ň„◊ÓļůĹŠĻŻ
÷ĽŃ– Ĺ£¨≤Ľ”√ľ∆ň„◊ÓļůĹŠĻŻ![]() °£
°£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņľ◊īľ”÷≥∆°įńĺīľ°Ī£¨ «őř…ę”–ĺ∆ĺę∆Ýő∂“◊Ľ”∑ĘĶń”–∂ĺ“ļŐŚ°£ľ◊īľ «÷ō“™ĶńĽĮ—ßĻ§“ĶĽýī°‘≠ŃŌļÕ“ļŐŚ»ľŃŌ£¨Ņ…”√”ŕ÷∆‘žľ◊»©ļÕŇ©“©£¨≤Ę≥£”√◊ų”–ĽķőÔĶń›Õ»°ľŃļÕĺ∆ĺęĶńĪš–‘ľŃĶ»°£
£®1£©Ļ§“Ķ…ŌŅ…ņŻ”√CO2ļÕH2…ķ≤ķľ◊īľ£¨∑Ĺ≥Ő Ĺ»ÁŌ¬£ļ
CO2£®g£©£ę3H2£®g£©![]() CH3OH£®l£©£ęH2O £®g£© °ųH£ĹQ1kJ°§mol£≠1
CH3OH£®l£©£ęH2O £®g£© °ųH£ĹQ1kJ°§mol£≠1
”÷≤ť◊ ŃŌĶ√÷™£ļĘŔCH3OH£®l£©£ę1/2 O2£®g£©![]() CO2£®g£©£ę2H2£®g£© °ųH£ĹQ2kJ°§mol£≠1
CO2£®g£©£ę2H2£®g£© °ųH£ĹQ2kJ°§mol£≠1
ĘŕH2O£®g£©=H2O£®l£© °ųH= Q3kJ°§mol£≠1£¨‘ÚĪŪ ĺľ◊īľĶń»ľ…’»»Ķń»»ĽĮ—ß∑Ĺ≥Ő Ĺő™______°£
ń≥Õ¨—ß…Ťľ∆Ńň“ĽłŲľ◊īľ»ľŃŌĶÁ≥ō£¨≤Ę”√ł√ĶÁ≥ōĶÁĹ‚200mL“Ľ∂®Ň®∂»ĶńNaCl”ŽCuSO4ĽžļŌ»‹“ļ£¨∆š◊į÷√»ÁÕľ£ļ
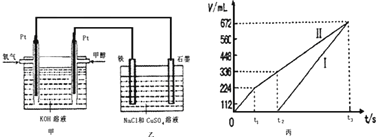
£®2£©ő™≥ż»•Ī•ļÕ ≥—őňģ÷–ĶńÔßłýņŽ◊”£¨Ņ…‘ŕľÓ–‘ŐűľĢŌ¬Õ®»Ž¬»∆Ý£¨∑ī”¶…ķ≥…Ķ™∆Ý°£ł√∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺő™___________________________________°£
£®3£©ĻżŃŅ¬»∆Ý”√Na2S2O3≥ż»•£¨∑ī”¶÷–S2O32-ĪĽ—űĽĮő™SO42-°£»ŰĻżŃŅĶń¬»∆Ýő™1°Ń10-3mol£¨‘ÚņŪ¬Ř…Ō…ķ≥…ĶńSO42-ő™_____________mol°£
£®4£©–ī≥Ųľ◊÷–Õ®»Žľ◊īľ’‚“ĽľęĶńĶÁľę∑ī”¶ Ĺ______________________°£
£®5£©ņŪ¬Ř…Ō““÷–ŃĹľęňýĶ√∆ÝŐŚĶńŐŚĽżňś ĪľšĪšĽĮĶńĻōŌĶ»ÁĪŻÕľňý ĺ£®“—ĽĽň„≥…ĪÍ◊ľ◊īŅŲŌ¬ĶńŐŚĽż£©£¨–ī≥Ų‘ŕt1ļů£¨ ĮńęĶÁľę…ŌĶńĶÁľę∑ī”¶ Ĺ____________£¨‘≠ĽžļŌ»‹“ļ÷– NaClĶńőÔ÷ ĶńŃŅŇ®∂»ő™___________mol/L°££®…Ť»‹“ļŐŚĽż≤ĽĪš£©
£®6£©ĶĪŌÚ…Ō Ųľ◊◊į÷√÷–Õ®»ŽĪÍŅŲŌ¬Ķń—ű∆Ý336mL Ī£¨ņŪ¬Ř…Ō‘ŕŐķĶÁľę…ŌŅ…őŲ≥ŲÕ≠Ķń÷ ŃŅő™_____________g°£
£®7£©»Ű Ļ…Ō ŲĶÁĹ‚◊į÷√ĶńĶÁŃų«Ņ∂»īÔĶĹ5£ģ0A£¨ņŪ¬Ř…Ō√Ņ∑÷÷””¶ŌÚłļľęÕ®»Ž∆ÝŐŚĶń÷ ŃŅő™_____________Ņň°££®“—÷™1łŲĶÁ◊”ňýīÝĶÁŃŅő™1£ģ6°Ń10-19C£¨ľ∆ň„ĹŠĻŻĪ£ŃŰŃĹőĽ”––ß ż◊÷£©
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ“—÷™ń—»‹–‘őÔ÷ K2SO4°§MgSO4°§2CaSO4‘ŕňģ÷–īś‘ŕ»ÁŌ¬∆Ĺļ‚£ļK2SO4°§MgSO4°§2CaSO4 (s)![]() 2Ca2£ę£ę2K£ę£ęMg2£ę£ę4SO42£≠°£≤ĽÕ¨ő¬∂»Ō¬£¨K£ęĶńĹĢ≥ŲŇ®∂»”Ž»‹ĹĢ ĪľšĶńĻōŌĶ»ÁÕľňý ĺ£¨‘ÚŌ¬Ń–ňĶ∑®īŪőůĶń «
2Ca2£ę£ę2K£ę£ęMg2£ę£ę4SO42£≠°£≤ĽÕ¨ő¬∂»Ō¬£¨K£ęĶńĹĢ≥ŲŇ®∂»”Ž»‹ĹĢ ĪľšĶńĻōŌĶ»ÁÕľňý ĺ£¨‘ÚŌ¬Ń–ňĶ∑®īŪőůĶń «
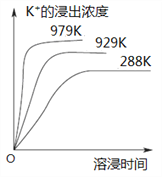
A.ł√∆Ĺļ‚ĶńKsp£Ĺc2(Ca2£ę)°§c2(K£ę)°§c(Mg2£ę)°§c4(SO42£≠)B.ŌÚł√ŐŚŌĶ÷–ľ”»ŽĪ•ļÕK2SO4»‹“ļ£¨»‹Ĺ‚∆Ĺļ‚ŌÚ◊ů“∆∂Į C.…żłŖő¬∂»£¨»‹ĹĢňŔ¬ ‘Ųīů£¨∆Ĺļ‚ŌÚ’ż∑ī”¶∑ĹŌÚ“∆∂Į D.ŌÚł√ŐŚŌĶ÷–ľ”»ŽĪ•ļÕNaOH»‹“ļ£¨»‹Ĺ‚∆Ĺļ‚≤Ľ∑Ę…ķ“∆∂Į
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ≥£ő¬Ō¬£¨Ō¬Ń–łų◊ťņŽ◊”‘ŕ÷ł∂®»‹“ļń‹īůŃŅĻ≤īśĶń «
A.pH£Ĺ1Ķń»‹“ļ÷–£ļFe2£ę°ĘNO3-°ĘSO42-°ĘNa£ę
B.”…ňģĶÁņŽĶńc(H£ę)£Ĺ1°Ń10£≠14mol°§L£≠1Ķń»‹“ļ÷–£ļCa2£ę°ĘK£ę°ĘCl£≠°ĘHCO3-
C.![]() £Ĺ1012Ķń»‹“ļ÷–£ļNH4+°ĘAl3£ę°ĘNO3-°ĘCl£≠
£Ĺ1012Ķń»‹“ļ÷–£ļNH4+°ĘAl3£ę°ĘNO3-°ĘCl£≠
D.c(Fe3£ę)£Ĺ0.1 mol°§L£≠1Ķń»‹“ļ÷–£ļK£ę°ĘClO£≠°ĘSO42-°ĘSCN£≠
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ≥£ő¬Ō¬£¨Ō¬Ń–łų◊ťņŽ◊”‘ŕ÷ł∂®Ľ∑ĺ≥÷–ń‹īůŃŅĻ≤īśĶń «(°°°°)
A.‘ŕ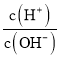 £Ĺ1013Ķń»‹“ļ÷–£ļNH4+°ĘCa2£ę°ĘCl-°ĘK£ę
£Ĺ1013Ķń»‹“ļ÷–£ļNH4+°ĘCa2£ę°ĘCl-°ĘK£ę
B.”…ňģĶÁņŽ≥ŲĶńc(H+)=1°Ń10£≠13mol/LĶń»‹“ļ÷–£ļNa£ę°ĘHCO3-°ĘCl-°ĘK£ę
C.őř…껋“ļ÷–Ņ…ń‹īůŃŅīś‘ŕAl3+°ĘNH4+°ĘCl-°ĘS2-
D.÷––‘»‹“ļ÷–Ņ…ń‹īůŃŅīś‘ŕFe3+°ĘK+°ĘCl-°ĘSO42-
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ “ő¬Ō¬£¨Ō¬Ń–łų◊ťņŽ◊”ń‹īůŃŅĻ≤īśĶń «£®°°°°£©
A. Ō°ŃÚňŠ÷–£ļK+°ĘMg2+°ĘA1O2-°ĘS2O32-
B. KW/c(H+)=10-13 mol°§L-1 Ķń»‹“ļ÷–£ļFe3+°ĘNH4+°ĘMg2+°ĘSO42-
C. Ļľ◊Ľý≥»ĪšļžĶń»‹“ļ÷–£ļFe2+°ĘMnO4©Ā°ĘNa+°ĘSO42©Ā
D. Õ®»ŽīůŃŅ CO2 Ķń»‹“ļ÷–£ļNa+°ĘClO-°ĘCH3COO-°ĘHCO3-
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ¬ťĽ∆ňōM «ń‚ĹĽł–…Ůĺ≠“©°£ļŌ≥…MĶń“Ľ÷÷¬∑ŌŖ»ÁÕľňý ĺ£ļ
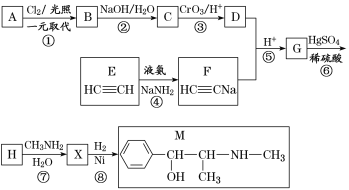
“—÷™£ļĘŮ£ģ∑ľŌ„ŐĢAĶńŌŗ∂‘∑÷◊”÷ ŃŅő™92
ĘÚ£ģR°™CH2OH![]() RCHO
RCHO
III£ģR1-CHO+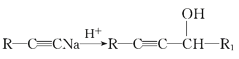
IV£ģ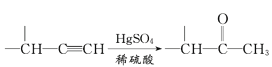
V£ģ
«ŽĽōīūŌ¬Ń–ő Ő‚£ļ
£®1£©DĶń√Ż≥∆ «_______£ĽG÷–ļ¨—űĻŔń‹ÕŇĶń√Ż≥∆ «_______°£
£®2£©∑ī”¶ĘŕĶń∑ī”¶ņŗ–Õő™_______£ĽAĶńĹŠĻĻľÚ Ĺő™_______°£
£®3£©–ī≥Ų∑ī”¶ĘŖĶńĽĮ—ß∑Ĺ≥Ő Ĺ£ļ______________________________°£
£®4£©X∑÷◊”÷–◊Ó∂ŗ”–_______łŲŐľ‘≠◊”Ļ≤∆Ĺ√ś°£
£®5£©‘ŕHĶńÕ¨∑÷“žĻĻŐŚ÷–£¨Õ¨ Īń‹∑Ę…ķňģĹ‚∑ī”¶ļÕ“ÝĺĶ∑ī”¶Ķń∑ľŌ„◊ŚĽĮļŌőÔ÷–£¨ļňīŇĻ≤’Ů«‚∆◊…Ō”–4◊ť∑Ś£¨«“∑Ś√śĽż÷ģĪ»ő™1°√1°√2°√6Ķń”–ĽķőÔĶńĹŠĻĻľÚ Ĺő™_________________°£
£®6£©“—÷™£ļ![]() ∑¬’’…Ō ŲŃų≥Ő£¨…Ťľ∆“‘ĪĹ°Ę““»©ő™÷ų“™‘≠ŃŌļŌ≥…ń≥“©őÔ÷–ľšŐŚ
∑¬’’…Ō ŲŃų≥Ő£¨…Ťľ∆“‘ĪĹ°Ę““»©ő™÷ų“™‘≠ŃŌļŌ≥…ń≥“©őÔ÷–ľšŐŚ![]() Ķń¬∑ŌŖ________________°£
Ķń¬∑ŌŖ________________°£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ“—÷™H2O2°ĘKMnO4°ĘNaClO°ĘK2Cr2O7ĺýĺŖ”–«Ņ—űĽĮ–‘°£Ĺ껋“ļ÷–ĶńCu2£ę°ĘFe2£ę°ĘFe3£ę≥ŃĶŪő™«‚—űĽĮőÔ£¨–Ť»‹“ļĶńpH∑÷Īūő™6.4°Ę9.6°Ę3.7°£Ō÷”–ļ¨FeCl2‘”÷ Ķń¬»ĽĮÕ≠ĺßŐŚ(CuCl2°§2H2O)£¨ő™÷∆»°īŅĺĽĶńCuCl2°§2H2O£¨ ◊Ō»Ĺę∆š÷∆≥…ňģ»‹“ļ£¨»ĽļůįīÕľ ĺ≤Ĺ÷ŤĹÝ––ŐŠīŅ£ļ
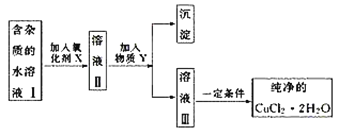
«ŽĽōīūŌ¬Ń–ő Ő‚£ļ
£®1£©Īĺ Ķ—ť◊Ó ļŌĶń—űĽĮľŃX «___(ŐÓ–ÚļŇ)°£
A£ģK2Cr2O7 B£ģNaClO C£ģH2O2 D£ģKMnO4
£®2£©őÔ÷ Y «____°£
£®3£©Īĺ Ķ—ť”√ľ”ľÓ≥ŃĶŪ∑®ń‹≤Ľń‹īÔĶĹńŅĶń£Ņ___£¨‘≠“Ú «___°£
£®4£©≥ż»•Fe3£ęĶń”–ĻōņŽ◊”∑Ĺ≥Ő Ĺ «____°£
£®5£©ľ”—űĽĮľŃĶńńŅĶń «____°£
£®6£©◊Óļůń‹≤Ľń‹÷ĪĹ”’Ű∑ĘĹŠĺßĶ√ĶĹCuCl2°§2H2OĺßŐŚ___£¨”¶»Áļő≤Ŕ◊ų___°£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ļķľ —ß–£”Ň—° - Ń∑Ōį≤ŠŃ–ĪŪ - ‘Ő‚Ń–ĪŪ
ļĢĪĪ °Ľ•Ń™ÕÝő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®∆ĹŐ® | ÕÝ…Ō”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | ĶÁ–Ň’©∆≠ĺŔĪ®◊®«Ý | …śņķ ∑–ťőř÷ų“Ś”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | …ś∆ů«÷»®ĺŔĪ®◊®«Ý
ő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®ĶÁĽį£ļ027-86699610 ĺŔĪ®” Ōš£ļ58377363@163.com