
| A. | 该变化说明原子核在化学反应中也能发生变化 | |
| B. | 该变化遵循质量守恒定律 | |
| C. | 1n是一种电中性粒子 | |
| D. | 对于30P:原子序数=质子数=中子数=核外电子数 |
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )的同分异构体有多种.符合下列条件的同分异构体有( )种
)的同分异构体有多种.符合下列条件的同分异构体有( )种| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应进行30s时,正反应速率等于逆反应速率 | |
| B. | 反应进行80s时,逆反应速率大于正反应速率 | |
| C. | 前60 s,以X浓度变化表示的平均反应速率为0.0005mol/(L•s) | |
| D. | 反应进行80s时,X物质的量浓度为0.04mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键在形成蛋白质结构和DNA双螺旋结构中起关键作用 | |
| B. | 原子光谱可用于测定物质中元素的种类 | |
| C. | a粒子散射实验及布朗运动的发现都对原子模型建立做出了贡献 | |
| D. | X-射线衍射实验可以用来鉴别晶体和非晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:| 滴定次数 | 滴定起始读数(mL) | 滴定终点读数(mL) |
| 第一次 | 1.08 | 见右图 |
| 第二次 | 2.02 | 24.52 |
| 第三次 | 1.00 | 20.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
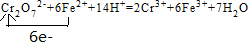 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ |
| N2O5 | 41 | 32 (升华) |
| N2O4 | -11 | 24 |
 ,相对分子质量137).步骤如下:在三口烧瓶中放入催化剂和30mL N2O5的CH2Cl2溶液(N2O5的浓度为lmol•L-1),30℃时,滴加15mL甲苯,充分反应得对硝基甲苯 1.73g.回答下列问题:
,相对分子质量137).步骤如下:在三口烧瓶中放入催化剂和30mL N2O5的CH2Cl2溶液(N2O5的浓度为lmol•L-1),30℃时,滴加15mL甲苯,充分反应得对硝基甲苯 1.73g.回答下列问题: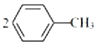 +N2O5$→_{△}^{催化剂}$
+N2O5$→_{△}^{催化剂}$ +H2O.
+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com