
某工厂废水中含![]() 的
的![]() ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料![]() 的流程图:
的流程图:
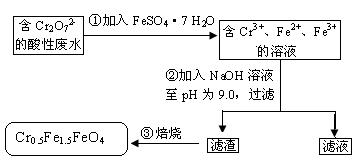
下列有关判断错误的是
A.操作①中反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
B.操作②所得的滤渣成分主要为Fe(OH)3、Fe(OH)2、Cr(OH)3
C.磁性材料Cr0.5Fe1.5FeO4中,显+3价铁与显+2价的铁的质量之比为2:3
D.若废水中杂质不与绿矾反应,将该l L废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4,理论上需加入绿矾13.9 g
C
①步骤,在酸性溶液中Cr2O72-与Fe2+反应生成Cr3+,Fe3+,H??2O 离子方程式为
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,A选项正确;向含Fe2+、Fe3+、Cr3+的溶液中加入氢氧化钠溶液后,得到三种沉淀:Fe(OH)2、Fe(OH)3、Cr(OH)3,B选项正确;这三种氢氧化物焙烧失水得到磁性材料Cr0.5Fe1.5FeO4,元素化合价没有变化,该化学式中Cr显+3价,若+2价铁为1.5 mol,+3价铁为1 mol,则正化合价代数和为3×0.5+2×1.5+3×1=7.5,负化合价代数和为(-2)×4=8,化学式总的化合价代数之和不等于0,由此说明,+2价铁为1mol,+3价铁为1.5 mol,故说明该材料中,n(Fe2+):n(Fe3+)=1mol:1.5mol=2:3,C选项不正确;D选项,根据关系式知:Cr2O72-~4Cr0.5Fe1.5FeO4 ~10 FeSO4·7 H2O 。理论上,1L废液中含有Cr2O72-:n(Cr2O72-)=5.00×10-3 mol/L×1 L=5.00×10-3mol,根据(1)中离子方程式知,理论上需要绿矾:m(FeSO4·7H2O)=5.00×10-3mol×278 g/mol=13.9 g,D选项正确。


科目:高中化学 来源: 题型:
(9分)某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.00 mL于锥形瓶中,加入10.00 mL KI溶液(足量),滴入指示剂2—3滴。
②取一滴定管依次用自来水、蒸馏水洗净,然后注入0.01 mol·L-1Na2S2O3溶液(显碱性),调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3====2NaI+Na2S4O6。
试完成下列问题:
(1)步骤①加入的指示剂是____________________。
(2)步骤②应使用__________式滴定管。
(3)步骤③当待测液由___________色变为__________色且不再变化即达终点,若耗去Na2S2O3溶液20.00 mL,则废水中Cl2的物质的量浓度为____________________。
(4)Cl2的实际浓度比所测浓度应_____________(“偏大”“偏小”或“相等”),造成误差的原因是_______________________________。(若认为没有误差,此问不答)
查看答案和解析>>
科目:高中化学 来源:2015届云南省高二上学期期中考试化学试卷(解析版) 题型:实验题
某工厂废水中含游离态氯(即含有氯分子Cl2),通过下列实验测定其浓度:
①取废水样10.0mL于锥形瓶,加入10.0 mL KI溶液(足量),滴入指示剂2-3滴。
②取一滴定管依次用自来水,蒸馏水洗净,然后就注入0.01 mol·L-1 的Na2S2O3标准液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2 + 2Na2S2O3 = 2NaI + Na2S4O6 (Na2S4O6溶液为无色)。试回答下列问题:
(1)步骤①加入的指示剂是 。
(2)步骤①反应的离子方程式是 。
(3)步聚③当待测液由 色变为 色且30s不再变化即达终点,若耗去Na2S2O3溶液20.00mL,则废水中C12的物质的量浓度为 。
(4)按照上述实验操作,最后会导致所测得的Cl2的物质的量浓度会比实际浓度 (填“偏大”、“偏小”或“相等”)。
(5)若读Na2S2O3溶液的体积不规范,没有平视,滴定前仰视,滴定后又俯视,最后会导致所测得的Cl2的物质的量浓度会比实际浓度 (填“偏大”、“偏小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源:2013届吉林省松原市高二上学期12月份月考化学试卷 题型:实验题
(18分)某工厂废水中含游离态氯,通过下列实验测定其浓度。
① 取水样10.0mL于锥形瓶,加入10.0mLKI溶液(足量),滴入指示剂2—3滴
② 取一滴定管依次用自来水,蒸馏水洗净,然后注入0.01mol/L的Na2S2O3溶液,调整液面,记下读数。
③ 将锥形瓶置于滴定管下进行滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6
请回答下列问题:
(1) 步骤①加入的指示剂是
(2) 步骤②应使用 式滴定管
(3) 步骤③当待测液由 色变为 色且半分钟不变化即达终点,若耗去Na2S2O3溶液20.0mL,则废水中Cl2的物质的量浓度为
(4) 从实验操作步骤上看,氯气的实际浓度比所测浓度 (填“偏大”、“偏小”或“相等”)
查看答案和解析>>
科目:高中化学 来源:2012届浙江省高二下学期第一次质量检测化学试卷 题型:填空题
某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.00mL于锥形瓶中,加入10.00mL KI溶液(足量),滴入指示剂2~3滴。
②取一只碱式滴定管依次用自来水、蒸馏水洗净,然后注入0.010 mol·L-1 Na2S2O3溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+Na2S4O6。
试回答下列问题:
(1)步骤①加入的指示剂是 。
(2)滴定时,眼睛应注视____________________,
判断到达滴定终点的现象是 ,
若耗去Na2S2O3溶液20.00mL,则废水中Cl2的物质的量浓度为__________________。
(3)Cl2的实际浓度比所测浓度应__________________(“偏大”、“偏小”或“相等”),造成误差的原因是 。(若认为没有误差,此问不答)
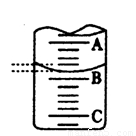
(4)右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的 刻度为25,滴定管中液面读数应为 mL,设此时液体体积读
数为a ml ,滴定管中液体的体积 V (=、>、<) ( 50-a )ml
(5)滴定结束时俯视刻度线读取滴定终点时Na2S2O3溶液的体积,会导致测定结果 (“偏大”、“偏小”或“不影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com