
��CO2��NH3Ϊԭ�Ͽɺϳɻ�������[��ѧʽΪCO(NH2)2]����֪��
��2NH3(g)+CO2(g)��NH2CO2 NH4(s) +l59.5 kJ·mol-1
��NH2CO2NH4(s) ��CO(NH2)2(s)+H2O(g) -116.5 kJ·mol-1
��H2O(1) ��H2O(g) -44.0kJ·mol-1
д��CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽ

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��(Sr)������������Ԫ�أ��䵥�ʺͻ�����Ļ�ѧ������ơ��������ơ�ʵ�����ú�̼���ȵķ���(��SrCO3 38.40%��SrO12.62%��CaCO3 38.27%��BaCO3 2.54%���������������������8.17%)�Ʊ������ȴ�Ʒ�IJ���ʵ��������£�
 |
39������Ũ�������������Ϊ65%���ܶ�Ϊ1.4g/cm3��Ҫ����30%ϡ����500mL������Ҫ���ĵ������� �������ƹ����в�ʹ����ƽ�������Ҫ����������� ������Ҫʹ�õ������� ��
��֪�����ε��ܽ��(g/100 gˮ)���±�
| �¶�/������ | 0 | 20 | 30 | 45 | 60 | 80 | 100 |
| Sr(NO3)2 | 28.2 | 40.7 | 47 | 47.2 | 48.3 | 49.2 | 50.7 |
| Ca(NO3)2��4H2O | 102 | 129 | 152 | 230 | 300 | 358 | 408 |
40���ɽ�ȡ��õ��Ļ�����Ʊ������ȴ�Ʒ��ʵ�鲽������Ϊ�����ˡ� �� ��ϴ�ӣ����
��֪��������������л��ܼ�A�С�ʽ����Sr(NO3)2�C212��Ba(NO3)2�C261��Ca(NO3)2�C164
41���Ƶõ������ȴ�Ʒ�к�����Ca(NO3)2��Ba(NO3)2�����ʡ��ⶨ�����ȴ��ȵ�ʵ�����£���ȡ5.39g��������Ʒ�������������л��ܼ�A�������ˡ�ϴ�ӡ������ʣ�����5.26g�����˹������250 mL����Һ��ȡ��25.00 mL������pHΪ7������ָʾ������Ũ��Ϊ0.107mol/L��̼������Һ�ζ����յ㣬����̼������Һ22.98mL��
�ζ����̵ķ�Ӧ��Sr2����CO32���� SrCO3������Ba2����CO32���� BaCO3��
�ٵζ�ѡ�õ�ָʾ��Ϊ ���ζ��յ�۲쵽������Ϊ ��
�ڸ������ȴ�Ʒ�У������ȵ���������Ϊ ��С���������λ�������ζ�ǰ��Ʒ��Ca(NO3)2û�г��������ⶨ�������ȴ��Ƚ��� (�ƫ�ߡ�����ƫ�͡����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������岻��ȱ�ٵ���Ԫ�أ������������壨FeSO4·7H2O����ҽҩ������Ѫ����ij����С��ⶨ�ò�Ѫ������Ԫ�صĺ�����������ò�Ѫ���Ƿ���ʡ�ʵ�鲽�����£�

��1��ʵ�������Ѿ�ȷ��ȡ��Ũ��������500 mL 1 mol·L-1��������Һ��������ʱ�õ����������ձ���500mL����ƿ�⣬����Ҫ ��
��2������ڼ��������ˮ������Ӧ�����ӷ���ʽΪ ��
��3���������һϵ�в�������Ϊ ��ϴ�ӡ����ա���ȴ��������
��4����ʵ������ģ���ò�Ѫ������Ԫ�ص���������Ϊ ��
��5��ijͬѧ���ֲ��ֲ�Ѫ��ҩƬ���淢�ƣ�ȡ��Ʒ��ϸ������1 mol·L-1��������Һ�����ˡ�ȡ��Һ�� _______________��Һ����Һ���˵���ò�Ѫ���Ѳ��ֱ��ʡ����ɫ�����Һ�м����֭����Һ��ɫ��ȥ��˵����֭������ �ԣ����������ԭ���������ʡ�
��6�����м��飨5������Һ���Ƿ���Fe2+Ӧѡ�õ��Լ��� ��
A��KSCN��Һ B������KMnO4��Һ C������ D��FeCl3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��SO2����������Fe2(SO4)3��Һ��ȫ��Ӧ���ټ���K2Cr2O7��Һ����������������ѧ��Ӧ��
��SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
��Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
�����й�˵���������
A��������Cr2O72->Fe3+>SO2
B��K2Cr2O7�ܽ�Na2SO3������Na2SO4
C��ÿ��1molK2Cr2O7�μӷ�Ӧ��ת�Ƶ��ӵ���ĿΪ6NA
D����6.72 L SO2(��״��)�μӷ�Ӧ������������0.2molK2Cr2O7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ڹ�ũҵ����������ҪӦ�á�
��ԭ�ӵ������ĵ����Ų�ʽ��______________����ԭ�Ӻ����_______�ֲ�ͬ�����ĵ��ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ������M��ij�ֽ�����ʹҩ����AΪԭ�ϵĹ�ҵ�ϳ�·������ͼ��ʾ��
������M��ij�ֽ�����ʹҩ����AΪԭ�ϵĹ�ҵ�ϳ�·������ͼ��ʾ��
|
 ��֪��
��֪��

 �� +
�� +  + CH3COOH
+ CH3COOH
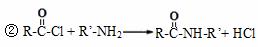
���������գ�
д����Ӧ���ͣ� ��Ӧ�� ��Ӧ�� ��
A�ṹ��ʽ�� ����A�ϳ�D������Ҫ �����������ɡ�
д����Ӧ�ܵĻ�ѧ����ʽ��
��
B���б����ṹ��ͬ���칹������һ������NaOH(aq)�з���ˮ�⡣1mol���л����������NaOH mol��д�����������������е�F��ͬ���칹��Ľṹ��ʽ��
����һ�ַ����廯��� ������-����� �۱�������4�ֲ�ͬ��������ԭ��
�� �� B����һ����ɣ�����Ϳ��ܵ�ԭ��
�� B����һ����ɣ�����Ϳ��ܵ�ԭ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ���¶��£����������ܱ������зֱ�������������Ӧ����H2(g)��I2(g) 2HI(g) ��C(s)��H2O(g)
2HI(g) ��C(s)��H2O(g) CO(g)��H2(g)������״̬�ܱ�������Ӧ���ﵽƽ��״̬����
CO(g)��H2(g)������״̬�ܱ�������Ӧ���ﵽƽ��״̬����
a. �����ʵ�Ũ�Ȳ��� b. ����������ѹǿ����
c. �����������ܶȲ��� d. ������������ɫ����
e. ����ֵ����ʵ���������������������
A. abc B. ade C. ae D. ac
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������������������������ܹ��������·�Ӧ��
MnO4- + H2C2O4 + H+ —— Mn2+ + CO2��+ H2O��δ��ƽ��
��ͬѧ�о�������ضԷ�Ӧ����Ӱ�죬�������ʵ�鷽����
��4 mL 0.001 mol/L KMnO4��Һ��2 mL 0.01 mol/L H2C2O4��Һ���о���ͬ�����Ի�ѧ��Ӧ���ʵ�Ӱ�졣�ı���������£�
| ��� | 10%�������/mL | �¶�/�� | �������� |
| A | 2 mL | 20 | |
| B | 2 mL | 20 | 10�α���MnSO4��Һ |
| C | 2 mL | 30 | |
| D | 1 mL | 20 | V1 mL����ˮ |
| E | 0.5 mL | 20 | V2 mL����ˮ |
(1)�������ʵ�鷽����ƣ����У� V1= ��V2= ��
(2) ����о��¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬ʹ��ʵ�� �� ��
(3) ��ͬѧ����A��ʵ��ʱ�����ַ�Ӧ��ʼʱ���ʽ��������ӿ졣��������Ϊ���������
������Һ�ķ�Ӧ���ȣ�������Һ�¶����ߣ���Ӧ���ʼӿ죻��Ӱ�컯ѧ��Ӧ���ʵ����ؿ���
����뻹������ ��
����ͬѧ������ͼ�ⶨ��Ӧ����

�ش���������
��4��ʵ��ʱҪ���װ�õ������ԣ����������ķ����� ��
��5����ͬѧͨ��������ͬ�����CO2����ʾ��Ӧ�����ʣ���Ҫ ������¼���ݡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
X��Y��ZΪ3�����壬��a mol X��b mol Y����һ�ܱ������У�������ӦX+2Y 2Z�ﵽƽ��ʱ�������ǵ����ʵ�������n(X)+n(Y)=n(Z)����Y��ת����Ϊ
2Z�ﵽƽ��ʱ�������ǵ����ʵ�������n(X)+n(Y)=n(Z)����Y��ת����Ϊ
A. ��100% B.
��100% B. ��100%
��100%
C.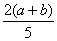 ��100% D.
��100% D. ��100%
��100%
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com