
下表为六种短周期元素的部分性质:
元素代号 | X | Y | Z | Q | R | T |
原子半径/10-10m | 0.77 | 0.74 | 0.75 | 1.17 | 0.99 | 1.10 |
主要化合价 | +4、 -4 | -2 | +5、 -3 | +4、 -4 | +7、 -1 | +5、 -3 |
下列有关说法错误的是
A.X与Y可以形成阴离子XY32-
B.元素R的氧化物对应的水化物一定为强酸
C.Z的氢化物的沸点比T的氢化物的沸点高
D.由X形成的化合物XY2和XR4,其中XR4的沸点高
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源:2015-2016学年山东寿光中学高一上10月月考化学试卷(解析版) 题型:选择题
下列溶液中c(Cl-)与50mL 1mol/L 氯化铝溶液中的c(Cl-)相等的是
A.150 mL 1mol/L氯化钠溶液 B.75 mL 2mol/L氯化铵溶液
C.150 mL 1mol/L氯化铁溶液 D.75 mL 1mol/L氯化亚铁溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
CoCl3·4NH3用H2SO4溶液处理再结晶,SO42—可以取代化合物中的Cl—,但NH3的含量不变,用过量的AgNO3处理该化合物,有含量1/3氯以AgCl析出,这种化合物应该是
A.[Co(NH3)4] Cl3 B.[Co(NH3)4 Cl3]
C.[Co(NH3)4 Cl] Cl2 D.[Co(NH3)4 Cl2] Cl
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上第一阶段测化学试卷(解析版) 题型:选择题
某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应A(g)+B(g)  C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.反应在前5 s的平均速率v(A)=0.17 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春市高三上学期期中测试化学试卷(解析版) 题型:填空题
(13分)甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
(1)一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是 (填序号)
A.每消耗1mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如下图所示。
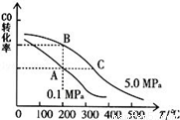
B、C两点的平衡常数K(B) K(C)(填“>”、“=”或“<”).
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得c(CO)=0.25mol/L,CO的转化率= ,此温度下的平衡常数K= (保留二位有效数字)
(2)常温下,将V mL、0.20mol/L氢氧化钠溶液逐滴加入到20.00mL、0.20mol/L甲酸溶液中,充分反应,溶液pH=7,此时V 20.00(填“>”、“=”或“<”);当氢氧化钠溶液与甲酸溶液恰好完全反应时,溶液中所含离子浓度由大到小顺序__ _____
(3)温度650℃的熔融盐燃料电池,用(CO、H2)作反应物,空气与CO2的混合气体为正极反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质.该电池的正极反应式为
(4)己知:CH3OH、H2的燃烧热(△H)分别为﹣726.5kJ/mol、﹣285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是
查看答案和解析>>
科目:高中化学 来源:2016届山东省滕州市高三上学期10月月考化学试卷(解析版) 题型:填空题
(13分)(一)已知水的电离平衡曲线如图所示,试回答下列问题:

(1)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_______ _
(2)B对应温度下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积与原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=___________________
(二)膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。
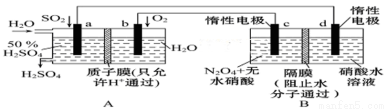
(1)A装置是________________,B装置是____________(填“原电池”或“电解池”)。
(2)N2O5在电解池的______________(填“c极”或“d极”)区生成,其电极反应式为__________________
(3)A装置中通入SO2一极的电极反应式为
(4)若A装置中通入SO2的速率为2.24 L·min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为_______________mL·min-1。
查看答案和解析>>
科目:高中化学 来源:2016届山东省滕州市高三上学期10月月考化学试卷(解析版) 题型:选择题
将0.1 mol·L-1的下列物质的水溶液,从常温加热到90 ℃,溶液的pH几乎不变的是(不考虑水的蒸发)
A.氯化钠 B.氢氧化钾 C.硫酸 D.硫酸铵
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃兰州一中高二上期中测试理科化学试卷(解析版) 题型:选择题
下列溶液中导电性最强的是
A.1L0.1mol/L醋酸 B.0.1L 0.1mol/L H2SO4溶液
C.0.5L 0.1mol/L盐酸 D.2L 0.1mol/L H2SO3溶液
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上10月阶段质检化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
B.升高温度能降低反应活化能,所以反应速率加快
C.中和热测定实验中需要用到的玻璃仪器有烧杯、温度计和环形玻璃棒搅拌棒三种
D.等量的CH4在氧气中燃烧放出的热量与形成燃料电池放出的热量一样多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com