
| A. | 由非金属元素形成的化合物一定不是离子化合物 | |
| B. | 含有金属元素的化合物一定是离子化合物 | |
| C. | 活泼金属与活泼非金属化合时,能形成离子键 | |
| D. | 第IA族和VIIA族原子化合时,一定生成离子键 |
分析 A.铵盐中均为非金属元素;
B.含有金属元素的化合物可能为共价化合物;
C.活泼金属易失去电子,活泼非金属易得到电子;
D.第IA族含H元素.
解答 解:A.由非金属元素形成的化合物可能为离子化合物,如铵盐,故A错误;
B.含有金属元素的化合物可能为共价化合物,如氯化铝为共价化合物,故B错误;
C.活泼金属易失去电子,活泼非金属易得到电子,则活泼金属与活泼非金属化合时,能形成离子键,故C正确;
D.第IA族含H元素,H与卤素原子化合以共价键结合,故D错误;
故选C.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意铵盐为特殊的离子化合物,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 可通过酸性高锰酸钾溶液来区别乙烷和乙炔 | |
| B. | 乙烯是石油裂解后的产物 | |
| C. | 石油的分馏、煤的干馏是物理变化,石油的裂解和裂化是化学变化 | |
| D. | 棉花、蛋白质、淀粉都是高分子化合物,都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

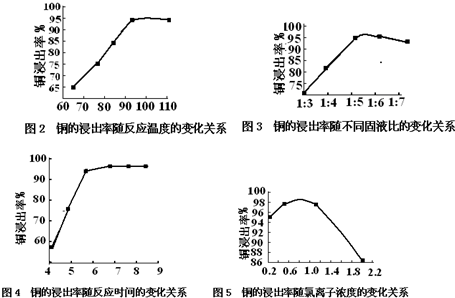
| 反应温度/℃ | 固液比 | c(Cl-)/mol•L-1 | 反应时间/h | |
| A | 95 | 1:5.5 | 0.8 | 6 |
| B | 100 | 1:5.5 | 0.7 | 7 |
| C | 110 | 1:6 | 0.9 | 8 |
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00mL | 0.02 | 40.01 |
| 2 | 25.00mL | 0.70 | 40.71 |
| 3 | 25.00mL | 0.20 | 39.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是中学中常见的物质,其转化关系如图所示(反应条件未标出),已知反应①是置换反应.
A、B、C、D、E、F是中学中常见的物质,其转化关系如图所示(反应条件未标出),已知反应①是置换反应. ,反应③的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,反应③的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiH4、PH3、H2S、HCl | B. | HF、HCl、HBr、HI | ||
| C. | PH3、H2S、HCl、HF | D. | NH3、PH3、AsH3、HF |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com