
| 元素 | 相关信息 |
| X | X原子的L层电子数是K层电子数的2倍 |
| Y | Y的单质存在Y2、Y3两种同素异形体 |
| Z | Z存在质量数为23,中子数为12的原子核 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
 ,二氧化碳的构型为直线形,即结构式为O=C=O,氢氧化钠是由钠离子和氢氧根构成的离子化合物,故存在离子键和共价键,
,二氧化碳的构型为直线形,即结构式为O=C=O,氢氧化钠是由钠离子和氢氧根构成的离子化合物,故存在离子键和共价键, ;O=C=O;离子键、共价键;
;O=C=O;离子键、共价键;
| ||
| ||


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
| A、11.2LCO和N2混合气体中含有的分子数是0.5NA |
| B、在铁参与的反应中,5.6g铁完全反应失去的电子数一定为0.3NA |
| C、1molNa2O和1molNa2O2中,含阴离子的数目均为NA |
| D、常温下,pH=12的1L氨水中含有的NH3?H2O分子数是0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
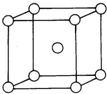 已知U、V、W、X、Y、Z均为元素周期表中前36号元素,且原子序数依次增大.U、V、W和X、Y分别为同一周期的主族元素,V原子p能级电子总数与s能级电子总数相等.U、Z原子中未成对电子数是同周期中最多的,且基态Z原子核外电子数是基态V原子核外电子数的3倍.X和Y原子的第一至第四电离能如表所示:
已知U、V、W、X、Y、Z均为元素周期表中前36号元素,且原子序数依次增大.U、V、W和X、Y分别为同一周期的主族元素,V原子p能级电子总数与s能级电子总数相等.U、Z原子中未成对电子数是同周期中最多的,且基态Z原子核外电子数是基态V原子核外电子数的3倍.X和Y原子的第一至第四电离能如表所示:| 电离能/kJ/mol | I1 | I2 | I3 | I4 |
| X | 738 | 1451 | 7733 | 10540 |
| Y | 578 | 1817 | 2745 | 11575 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 |
| Cr | 653 | 1592 | 2987 |
| Q | 759 | 1561 | 2957 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 预期的转化 | 选择的试剂 | 实验现象 | 结论(用化学方程式表示) |
| ① | S→SO2 | 硫磺、 氧气 | -- | |
| ② | SO2→S | 二氧化硫、 硫化氢 | --- | SO2+2H2S═3S↓+2H2O |
| ③ | SO2→H2SO4 | 二氧化硫、 氯水 | 氯水退色 | |
| ④ | H2SO4→SO2 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某无色溶液中:Na+、Cu2+、Cl-、MnO4- |
| B、含有大量Fe3+的溶液中:Na+、SO42-、K+、SCN- |
| C、含有大量NH4+的溶液中:Ba2+、K+、Cl-、OH- |
| D、在pH=1的溶液中:K+、Fe3+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质溶液的导电性不一定强于弱电解质溶液的导电性 |
| B、电解质溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数 |
| C、易溶物是强电解质,难溶物一定是弱电解质 |
| D、硫酸钡在水里的溶解度很小,但溶于水的硫酸钡全部电离,所以硫酸钡是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | 相关信息 |
| W | W的基态原子核外3个能级上有电子,且每个能级上的电子数相等. |
| X | X原子核外L层电子数为奇数 |
| Y | Y是地壳中含量最多的元素 |
| Z | Z在同周期元素的简单离子中半径最小 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com