
��16�֣���úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ��ú������
��1����ˮ����ͨ�����ȵ�̼���ɲ���ˮú������ӦΪ��
C(s)��H2O(g)
 CO(g)��H2(g) ��H=��131.3
kJ•mol-1��
CO(g)��H2(g) ��H=��131.3
kJ•mol-1��
�ٸ÷�Ӧ�ڳ����� �Է����У���ܡ��롰���ܡ�����
�ں��£����ݻ��ɱ���ܱ������У��������Ͽ��淴Ӧ��һ��ʱ��������������������仯ʱ���ܱ����÷�Ӧ�Ѵﵽƽ��״̬����
����������ܶȣ� �������������ѹǿ��
��������������ʵ����� ��CO���ʵ���Ũ��
A��ֻ�Т� B��ֻ�Т�͢� C��ֻ�Т�͢� D����͢�
��2��ˮú���ٽ�һ����Ӧ����ȡ��������ӦΪH2O(g)+CO(g) H2(g)+CO2(g)��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K= 4/9�����¶����ڼס��ҡ������������ܱ������У�ֻͶ��H2(g)��CO2(g)������ʼŨ�����±���ʾ�������жϲ���ȷ���� ��
H2(g)+CO2(g)��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K= 4/9�����¶����ڼס��ҡ������������ܱ������У�ֻͶ��H2(g)��CO2(g)������ʼŨ�����±���ʾ�������жϲ���ȷ���� ��
|
��ʼŨ�� |
�� |
�� |
�� |
|
c(H2)/mol/L |
0.010 |
0.020 |
0.020 |
|
c(CO2)/mol/L |
0.010 |
0.010 |
0.020 |
A����Ӧ��ʼʱ�����еķ�Ӧ������죬���еķ�Ӧ��������
B��ƽ��ʱ�����кͱ��У�2��ת���ʾ���60��
C��ƽ��ʱ�����У�(CO2)�Ǽ��е�2������0.012mol/L
D��ƽ��ʱ������CO2��ת���ʴ���60%
��3��Ŀǰ��ҵ����һ�ַ�������CO2�������״���һ�������·�����Ӧ��CO2(g)��3H2(g) CH3OH(g)��H2O(g) ����ͼ��ʾ�÷�Ӧ���й���������(��λΪkJ•mol��1)�ı仯�������Ϊ1 L�ĺ����ܱ������У�����1mol CO2��3mol H2��Ӧ
CH3OH(g)��H2O(g) ����ͼ��ʾ�÷�Ӧ���й���������(��λΪkJ•mol��1)�ı仯�������Ϊ1 L�ĺ����ܱ������У�����1mol CO2��3mol H2��Ӧ

�����д�ʩ����ʹc (CH3OH)������� ��
A�������¶�
B������He(g)��ʹ��ϵѹǿ����
C����H2O(g)����ϵ�з������
D���ٳ���1mol CO2��3mol H2
�����¶�T1ʱ������Ӧ�ﵽƽ��ʱ�����n(H2) = 2.4 mol�������������䣬���¶�T2ʱ������Ӧ�ﵽƽ��ʱ�����n(CO2) = 0.82 mol����T2 T1�������������������������
��4����һ�������¿�ѧ�Ҵ��̵����з����CO2��̫���ܵ�ص��ˮ������H2�ϳɼ״���CH3OH��H2��ȼ���ȷֱ�Ϊ����H����725.5kJ/mol����H����285.8kJ/mol��
��д����ҵ����CO2��H2�ϳ�CH3OH��Һ̬ˮ���Ȼ�ѧ����ʽ�� ��
�ڸ�ת���Ļ��������� ��
�����������������Ʒ�ӦCO2��C��O2����H��0����S��0��������CO2�Ի�����Ӱ�졣�����ж��Ƿ���в�˵�����ɣ�
(1) �� ���� �� D ��2��C (3) �� CD �� >
��4����CO2(g)��3H2(g)��CH3OH(l)��H2O(l) ��H����131.9kJ/mol
�ڿɽ�������ЧӦ���ֲ���Դ��ȱ
�۲����У��÷�Ӧ��һ���������ؼ��ķ�Ӧ�����Բ����Է�����
��������(1)��Ӧ���������ģ����ȷ��ȿ��淴Ӧ�������ڳ����²����Է����С���Ϊ���£����ݻ��ɱ���ܱ������н��У�����I���������˵����ֻ�е�CO���ʵ���Ũ�Ȳ��ٱ仯ʱ����˵����
��2����Ӧ��ʼʱ����Ũ�������Ũ����С����Ӧ���ʱ���죬����������Ϊ��Ӧǰ��������䣬���ͱ��з�Ӧ���Ũ��֮����ͬ��������ƽ���ǵ�Ч�ģ�����C����ȷ�����ݷ���ʽ��֪
H2(g)+CO2(g) 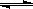 H2O(g)+CO(g)
H2O(g)+CO(g)
��ʼ����mol�� 0.010 0.010 0 0
ת������mol�� x x x x
ƽ������mol�� 0.010��x 0.010��x x x
���� �����x��0.006����ת������60�����������������Ũ�ȣ�������߶�����̼��ת���ʡ�
�����x��0.006����ת������60�����������������Ũ�ȣ�������߶�����̼��ת���ʡ�
��3������ͼ���֪�÷�Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ�������He(g)��ʹ��ϵѹǿ������ԭ��ϵ�����ʵ�Ũ�Ƚ���С��ƽ�����淴Ӧ�����ƶ�������������ˮ��Ũ�ȣ�ƽ��������Ӧ�����ƶ���c (CH3OH)�������ٳ���1mol CO2��3mol H2���൱��������ϵ��ѹǿ��ƽ��������Ӧ�����ƶ���c (CH3OH)�������¶�T2ʱ������Ӧ�ﵽƽ��ʱ�����n(CO2) = 0.82 mol�����ʱn(H2) =2.46 mol.��Ϊ��Ӧ���ȣ��¶�Խ�����������ʵ���Խ�࣬����T2����T1��
��4�����ݸ�˹���ɺ�ȼ���ȵ��Ȼ�ѧ����ʽ���Եõ�CO2��H2�ϳ�CH3OH��Һ̬ˮ���Ȼ�ѧ����ʽ���ڷ�Ӧ�����Ķ�����̼�����Կ��Խ�������ЧӦ��ͬʱ���ɼ״������ֲ���Դ��ȱ����Ϊ��H��0����S��0�����Ը÷�Ӧ�����Է����С�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| ���� |
| ���� |
| ʵ�� ��� |
�¶ȡ� | ��ʼ��/mol | ƽ��/mol | ��ƽ���� ��ʱ��/min | ||||
| H2O | CO | H2 | CO2 | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 0 | a | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0 | b | 0.4 | 1.6 | 3 |
| ���� |
| ��� | �¶� | ���� | �� |
| 1 | |||
| 2 | |||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 CO��g��+H2��g����H=+131.3kJ?mol-1��
CO��g��+H2��g����H=+131.3kJ?mol-1��| ��ѧ�� | C-O | C-H | H-H | C��O | O-H |
| ���� kg/mol-1 | 358 | 413 | 436 | 1072 | 463 |
 2NH3��g����H=-92.4kJ/mol
2NH3��g����H=-92.4kJ/mol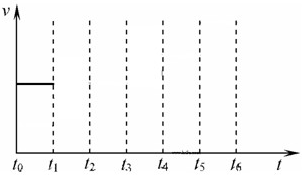 ��һ�������������У����ϳɰ���Ӧ�ﵽƽ�����t1ʱ�����¶ȣ�t2���´ﵽƽ�⣬t3ʱ���뵪����t4ʱ���´ﵽƽ�⣬t5ʱ��ȥһ���ֲ��t6ʱ�ִﵽƽ�⣬��������ķ�Ӧ������ʱ���ϵͼ�л���t1��t5�淴Ӧ���ʡ�t5��t6����Ӧ���ʵı仯�����
��һ�������������У����ϳɰ���Ӧ�ﵽƽ�����t1ʱ�����¶ȣ�t2���´ﵽƽ�⣬t3ʱ���뵪����t4ʱ���´ﵽƽ�⣬t5ʱ��ȥһ���ֲ��t6ʱ�ִﵽƽ�⣬��������ķ�Ӧ������ʱ���ϵͼ�л���t1��t5�淴Ӧ���ʡ�t5��t6����Ӧ���ʵı仯�����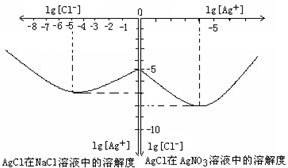
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO2 | |||
| 1 | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| 2 | 830 | 1 | 4 | 0.8 | 0.8 | 3 |
| 3 | 830 | a | b | c | d | t |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̣�
ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̣��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��2009?���ݶ�ģ��ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̣�
��2009?���ݶ�ģ��ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̣�| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com