
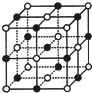
 已知NiXO晶体晶胞结构为NaCl型(如图),由于晶体缺陷,x值小于1.测知NiXO晶体x=0.88,晶胞边长为4.28×10-10m 求:(已知:$\sqrt{2}$=1.4)
已知NiXO晶体晶胞结构为NaCl型(如图),由于晶体缺陷,x值小于1.测知NiXO晶体x=0.88,晶胞边长为4.28×10-10m 求:(已知:$\sqrt{2}$=1.4)分析 (1)由于NiXO晶体晶胞结构为NaCl型,所以晶胞中两个Ni原子之间的最短距离为晶胞面对角线的$\frac{1}{2}$;
(2)采用沿X、Y、Z三轴切割的方法确定O2-的配位数,将Ni离子连接后观察所围成的空间几何构型;
(3)根据NiXO中化合价代数和为零可求得晶体中Ni2﹢与Ni3﹢的最简整数比,然后确定分子式;
(4)离子化合物中离子所带电荷越多,晶格能越大,熔沸点越高.
解答 解:(1)由于NiXO晶体晶胞结构为NaCl型,所以晶胞中两个Ni原子之间的最短距离为晶胞面对角线的$\frac{1}{2}$,由晶胞棱边长可求得晶胞面对角线为长为:$\sqrt{2}$×4.28×10-10m,所以$\frac{1}{2}$×4.28×10-10m=3.03×10-10m;
故答案为:3.03×10-10m;
(2)沿X、Y、Z三轴切割的方法知,X轴上有2个Ni离子,Y轴上有2个Ni离子,Z轴上有2个Ni离子,所以O2-的配位数是6,将6个Ni离子连接后所围成的空间几何构型正八面体;
故答案为:正八面体;
(3)设晶体中Ni2﹢与Ni3﹢的最简整数比为x:y,根据NiXO中化合价代数和为零可知$\frac{2x+3y}{x+y}$×0.88=2,由此解得x:y=8:3,此晶体的化学式:Ni0.64Ni0.24O;
故答案为:Ni0.64Ni0.24O;
(4)Ni2+、O2-电荷多,晶格能越大,熔沸点越高,所以NiO晶体熔点大于NaCl;
故答案为:Ni2+、O2-电荷多,晶格能大.
点评 本题考查物质结构和性质,涉及晶胞计算、晶格能、微粒空间构型判断等知识点,中等难度,注重基础知识的考查.


科目:高中化学 来源: 题型:解答题
| Zn的质量/g | Zn的形状 | 温度/℃ | 溶于酸的时间/s | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 45 | 25 |
| E | 2 | 薄片 | 45 | 25 |
| F | 2 | 薄片 | 15 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13.4 mL | B. | 22.40 mL | C. | 6.72 mL | D. | 0 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
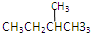 和
和
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com