
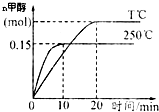
 将1molCO和2molH2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol,根据图示判断,下列结论正确的是( )
将1molCO和2molH2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol,根据图示判断,下列结论正确的是( )| A. | a<0,T<250 | |
| B. | 250℃时,0~10min内:v(H2)=0.015mol/(L•min) | |
| C. | CO的平衡转化率在250℃时比T℃大 | |
| D. | 250℃时,起始时向容器中改充1molCH3OH气体,恒温达平衡后,CH3OH的物质的量大于0.15mol |
分析 A、依据先拐先平的判断方法可知T<250℃,升高温度,甲醇物质的量减少,平衡逆移,所以正反应为放热反应,△H<0;
B、0~10min内甲醇物质的量增加了0.15mol,根据方程式求出氢气的变化量,再求速率;
C、已知该反应△H<0,而且T<250℃,温度越低CO的转化率越大;
D、250℃时,起始时向容器中改充1molCH3OH气体,与原平衡是等效平衡.
解答 解:A、依据先拐先平的判断方法可知T<250℃,升高温度,甲醇物质的量减少,平衡逆移,所以正反应为放热反应,△H<0,所以a<0,故A正确;
B、0~10min内甲醇物质的量增加了0.15mol,根据方程式氢气的变化量为:0.15mol×2=0.3mol,所以v(H2)=$\frac{\frac{0.3mol}{1L}}{10min}$=0.03mol/(L•min),故B错误;
C、已知该反应△H<0,而且T<250℃,温度越低CO的转化率越大,所以CO的转化率:T℃时大于250℃时,故C错误;
D、250℃时,起始时向容器中改充1molCH3OH气体,与原平衡是等效平衡,所以恒温达平衡后,CH3OH的物质的量等于0.15mol,故D错误;
故选A.
点评 本题考查物质的量随时间的变化图象,由明确图象中量的变化来分析反应速率、转化率、影响平衡的移动因素等,题目难度不大.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取7.13mL稀盐酸 | |
| B. | 用pH计测得某稀盐酸的pH为1.54 | |
| C. | 广泛pH试纸润湿后,测得某溶液的pH为2.3 | |
| D. | 用标准的盐酸滴定待测的NaOH溶液时,滴定完毕后,酸式滴定管中盐酸的读数为17.1mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸 | B. | NaCl | C. | AgNO3 | D. | KNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
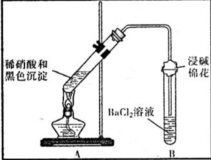 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | TiCl4在反应I中是还原产物,在反应Ⅱ中是氧化剂 | |
| B. | C、Mg在反应中均为还原剂,被氧化 | |
| C. | 每生成19.2 g Ti,反应Ⅰ、Ⅱ中共转移1.6 mol e- | |
| D. | 反应I中b=c=2,反应II中Mg的还原性大于Ti |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com