
有机物X室温下是液体,易溶于水,具有酸性,化学性质稳定,遇明火燃烧。
①取1.00g X,加入到50.00mL 0.300mol/L的标准NaOH溶液中;以酚酞为指示剂,有0.200mol/L的标准盐酸溶液滴定过量的NaOH溶液,消耗25.00mL。
②取1.00g X,在适量氧气中完全燃烧,在120℃下得到2种气体产物,其平均摩尔质量约为30g/mol;再用足量Ca(OH)2吸收此燃烧产物,得到3.17g沉淀。
1.通过计算,确定X的结构简式
2.为什么X呈现酸性
3.X有什么用途?
科目:高中化学 来源: 题型:阅读理解
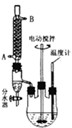 (2013?金华模拟)最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如下:
(2013?金华模拟)最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如下: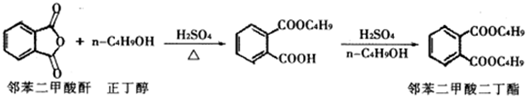


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com