
分析 (1)由①A(s)+O2(g)═CO2(g)△H=-393.51kJ/mol;②B(s)+O2(g)═CO2(g)△H=-395.41kJ/mol,根据盖斯定律:①-②分析反应的热效应,能量越高越不稳定;
(2)反应方程式为:H2+Cl2=2HCl,根据吸收的能量之和与放出的能量之和的相对大小判断反应的吸放热,二者的差值即为焓变的数值;
(3)据热化学方程式和盖斯定律计算写出热化学方程式;
(2)据图象写出水与甲烷反应的热化学方程式和氧气与甲烷反应的热化学方程式,再据热化学方程式计算.
解答 解:(1)由①A(s)+O2(g)═CO2(g)△H=-393.51kJ/mol;②B(s)+O2(g)═CO2(g)△H=-395.41kJ/mol,根据盖斯定律:①-②得:A(s)=B(s)△H>0,所以B的能量高,能量越高越不稳定,A稳定,故答案为:A;
(2)反应方程式为:H2+Cl2=2HCl,生成2molHCl,需吸收能量:436kJ+243kJ=679kJ,放出能量:2×431kJ=862kJ,放出的能量大于吸收的能量,则该反应放热,焓变为负号,且放出的热量为:864kJ-679kJ=185kJ,所以△H=-183KJ/mol,所以反应的热化学方程式是H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ/mol;
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ/mol;
(3)①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H1=-72kJ•mol-1
②CH4(g)+H2O(g)═CO(g)+3H2(g)△H2=+216 kJ•mol-1
依据盖斯定律$\frac{1}{2}$①-②得到氢气与氧气反应生成水蒸气的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-252kJ•mol-1,CH4(g)+H2O(g)═CO(g)+3H2(g);△H2=+216kJ•mol-1
,2CH4(g)+O2(g)═2CO(g)+4H2(g);△H1=-72kJ•mol-1,
若x=0.2,有0.8molH2O(g)和0.2molO2(g),0.2mol氧气反应放热0.2mol×36KJ/mol×2=14.4KJ;
反应①与②放出(或吸收)的总能量为0时,设水蒸气物质的量为amol,则氧气物质的量为(1-a)mol,有216KJ/mol×amol=72KJ/mol×(1-a)mol,解得:a=0.26mol,所以x=$\frac{1-0.26}{1}$=0.75;
故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-252kJ•mol-1;14.4;0.75.
点评 本题考查了据能量变化图书写热化学方程式和据热化学方程式的计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
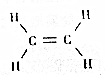
| A. | 乙烯是由碳、氢两种元素组成的 | |
| B. | 乙烯中碳元素的质量分数为85.7% | |
| C. | 乙烯是一种有机高分子化合物 | |
| D. | 乙烯中碳、氢两种元素的原子个数比是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率:乙>甲 | B. | 平衡时O2的浓度:乙>甲 | ||
| C. | 平衡时SO2的转化率:乙>甲 | D. | 平衡时SO2的体积分数:乙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蓝色石蕊试纸褪色 | B. | 蓝色石蕊试纸变红 | ||
| C. | 蓝色石蕊试纸先变红再褪色 | D. | 无现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
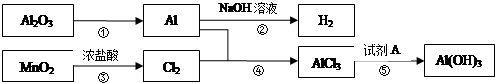
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
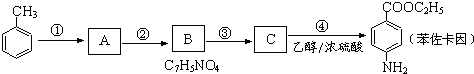
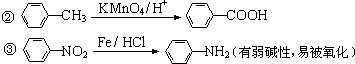
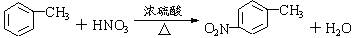 .
.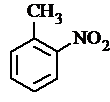 、
、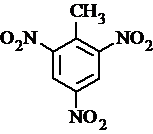 等
等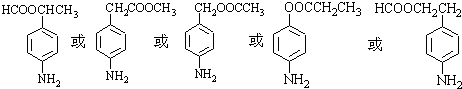 .
.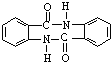 有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图.提示:①合成过程中无机试剂任选;②合成路线流程图示例如下:
有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图.提示:①合成过程中无机试剂任选;②合成路线流程图示例如下: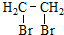
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧杯中固体有铁、无铜 | B. | 烧杯中固体有铜、无铁 | ||
| C. | 烧杯中固体铁、铜都有 | D. | 烧杯中固体铁、铜都无 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com