
| A. | CH2═CH2+Br2→CH3CHBr2 | |
| B. | CH3CH═CH2+Br2→CH3CHBrCH2Br | |
| C. | CH3CH═CH2+Br2→CH3CH2CHBr2 | |
| D. | CH2═CH-CH═CH2+Br2(足量)→CH2═CH-CHBr-CH2Br |
分析 A.应生成CH2BrCH2Br;
B.CH3CH═CH2与溴发生加成反应生成CH3CHBrCH2Br;
C.应生成CH3CHBrCH2Br;
D.CH2═CH-CH═CH2与足量溴反应,碳碳双键完全加成.
解答 解:A.应生成CH2BrCH2Br,方程式为CH2═CH2+Br2→CH2BrCH2Br,故A错误;
B.CH3CH═CH2与溴发生加成反应生成CH3CHBrCH2Br,故B正确;
C.应生成CH3CHBrCH2Br,方程式为CH3CH═CH2+Br2→CH3CHBrCH2Br,故C错误;
D.CH2═CH-CH═CH2与足量溴反应,碳碳双键完全加成,应生成CH2BrCHBrCHBrCH2Br,故D错误.
故选B.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,注意把握有机物的性质以及反应方程式的书写,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ①④ | C. | ②③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:Al3+、NH4+、Cl-、HCO3- | |
| B. | 甲基橙显红色的溶液中:Fe2+、Na+、SO42-、NO3- | |
| C. | 水电离出来的c(H+)=10-12mol•L-1的溶液:K+、HCO3-、I-、ClO- | |
| D. | pH值为1的溶液:Fe2+、Cl-、Na+、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+m=b-n | B. | a+b=m+n | C. | a-m=b+n | D. | a+m=b-n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含质子数=A-n | B. | 所含中子数=A-Z | C. | 所含电子数=Z+n | D. | 质量数=A+Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:
在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2mol H2、1mol CO | 1mol CH3OH | 4mol H2、2mol CO |
| 平衡时n(CH3OH) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1KJ | 吸收Q2KJ | 放出Q3KJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
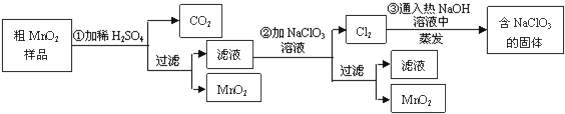
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com