
����Ŀ�����������ѳ�Ϊ��ǰ��δ����һ��ȫ�����ش���⣮Ϊ���Ŀǰȼ��ʹ�ù����еĻ�����Ⱦ���⣬��������ԴΣ�����е�ר���������̫���ܴ�ʹȼ��ѭ��ʹ�õĹ��룬��ͼ��ʾ��

����I�������·�Ӧ��ʾ��
��2CO2![]() 2CO+O2
2CO+O2
��2H2O![]() 2H2+O2
2H2+O2
��2N2+6H2O![]() 4NH3+3O2
4NH3+3O2
��2CO2+4H2O![]() 2CH3OH+3O2
2CH3OH+3O2
��2CO+H2O![]() +3O2
+3O2
��ش��������⣺
��1������I������ת����ʽΪ�� ��ת��Ϊ �ܣ�
��2������ɵڢݸ���Ӧ�Ļ�ѧ����ʽ
��3������ת�������У���H1�͡�H2�Ĺ�ϵ��
��4������1mol��ѧ�����������������
���ۼ� | H��N | H��O | N��N | O=O |
����1mol��ѧ����������/kJmol��1 | 393 | 460 | 941 | 499 |
�����£�N2��H2O��Ӧ����NH3���Ȼ�ѧ����ʽΪ
���𰸡���1��̫������ѧ��
��2��2CO+4H2O![]() 2CH4+3O2��
2CH4+3O2��
��3����H1=����H2��
��4��2N2��g��+6H2O��l��=4NH3��g��+3O2��g����H=+1189KJ/mol��
����������1����ͼ��֪�����̢���̫����ת��Ϊ��ѧ�ܣ��ʴ�Ϊ��̫������ѧ��
��2����ͼ��֪����Ϊ���飬�ʷ���ʽΪ��2CO+4H2O![]() 2CH4+3O2��
2CH4+3O2��
��3���ɸ�˹���ɺ������غ㶨�ɶ��ɿ�֪����H1=����H2��
��4�������£�N2��H2O��Ӧ����NH3�ķ�ӦΪ��
2N2��g��+6H2O��l��=4NH3��g��+3O2��g����
��Ӧ�ʱ��H=2��941KJ/mol+6��2��460KJ/mol
����4��3��393KJ/mol+3��499KJ/mol��=1189KJ/mol��
�Ȼ�ѧ����ʽΪ��2N2��g��+6H2O��l��=4NH3��g��+3O2��g����H=+1189KJ/mol��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2015���վ���һ������̼����ȼ�ϵ��ԭ��ʾ����ͼ�������йظõ�ص�˵����ȷ���ǣ� ��

A����ӦCH4��H2O![]() 3H2��CO,ÿ����1molCH4ת��12mol ����
3H2��CO,ÿ����1molCH4ת��12mol ����
B���缫A��H2����ĵ缫��ӦΪ��H2��2OH����2e��=2H2O
C����ع���ʱ��CO32����缫B�ƶ�
D���缫B�Ϸ����ĵ缫��ӦΪ��O2��2CO2��4e��=2CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.�������ʣ���16O��18O �ں��Ͱ��� ��CH3CH3��CH3CH2CH2CH3 ��CH3CH2CH2CH3 ��CH3CH (CH3) 2 ��O2��O3 �� ��
��
��1������ͬ����������ǣ�����ţ���ͬ��_______��
��2������ͬϵ�����_____________��
II.��ϩ�IJ���������������һ�����ҵ�ʯ�ͻ�����չˮƽ����ش�
��1����ϩ�Ľṹʽ��___________��
��2��������ϩ����ͨ��������Ȼ�̼��Һ�У���Ӧ�Ļ�ѧ����ʽΪ______��
��3������������ȥ�����л��е���ϩ���Լ���______��������ţ�
��ˮ ������ ����ˮ �����Ը��������Һ
��4����һ�������£���ϩ����ˮ��Ӧ�����л���A��A�Ľṹ��ʽ��______���䷴Ӧ������______��Ӧ���ȡ�����ӳɡ�����
��5�����л�ѧ��Ӧԭ����ͬ����______������ţ���
����ϩʹ������Ȼ�̼��Һ�����Ը��������Һ��ɫ
��SO2ʹ��ˮ�����Ը��������Һ��ɫ
��SO2ʹƷ����Һ�͵��з�̪��NaOH��Һ��ɫ
��.��ͼ��ʾΪCH4ȼ�ϵ�ص�װ�ã�A��BΪ���̼������

��1��_____����A��B�����缫���ͨ���飬��缫��ӦʽΪ______________��
��2�������ļ�������Ϊ11.2 L����״���£�ʱ������KOH������Ϊ_______g��
IV.Ǧ����������ʹ�õij���أ���Pb��PbO2�����ṹ�ɡ��õ�ع���ʱ�������ĵ缫��ӦΪ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2H2S+O2=2S+2H2O��Ӧ�У���ָ����������Ԫ���� �� ����ԭ��Ԫ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2015�㶫��������ʮ���ƣ�12CaO��7Al2O3)�����͵ij������Ϻͷ�����ϣ��ð���ʯ����Ҫ��CaCO3��MgCO3)�ͷ�AlƬ�Ʊ�����ʮ���ƵĹ������£�

��1���ѷ���Ҫ��MgO�� ����������NH4NO3��Һ��ȡ�ѷۺ�þ�����X�����ܣ� ����ҺI��c(Mg2+)С��5��10-6mol��L-1,����ҺpH���� ��Mg(OH)2��Ksp=5��10-12)���ù����в����ã�NH4)2SO4����NH4NO3��ԭ���� ��
��2����ҺI�е��������� ���������ʳɷֵ�Ӱ�죩������ҺI�н�ͨ��CO2�������� ���Ӷ�����CaCO3���ʽ��͡�
��3����NaOH��Һ�ɳ�ȥ��AlƬ���������Ĥ����Ӧ�����ӷ���ʽΪ ��
��4������Ʊ�Al(OH)3ʱ���缫�ֱ�ΪAlƬ��ʯī������ܷ�Ӧ����ʽΪ ��
��5��һ�ֿɳ��������������أ���ŵ�ʱAlCl4����Al2Cl7������������Al�缫���ת�����������Ӳ�����缫��Ӧ���ŵ�ʱ����Al�ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������������˵����ȷ����( )
A. ������������Ҳ������B. ���е����������״�
C. �������ؼ���������ת����Ӱ�����ǿ��D. �����������ص��̶ȴ��γɵĹ��ۼ�ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A�Ƿ���ʽΪC7H8�ķ���������֪����������һϵ��ת����ϵ������C��һ��һԪ����D��A�Ķ�λһȡ���H��E��I��F�ֱ�Ϊͬ���칹�壺

��1��������I�Ľṹ��ʽ��______________����ӦB��C�Ļ�ѧ����ʽ��__________��
��2�����ʵ��֤��H�к�����ԭ�ӣ������õ����Լ���_____________��
��3��Ϊ��֤E��F�ķ�Ӧ������E��G��ͬ������ʵ�鷽����ʵ���е���________
A����E��F��Ӧ��Ļ��Һ�м��������ữ���ټ���AgNO3��Һ�õ�����ɫ����
B����E��F��Ӧ��Ļ��Һ�м�����ˮ��������ˮ������ɫ
C����E��F��Ӧ��Ļ��Һ�м��������ữ�������CCl4��Һ��ʹ֮��ɫ
D����E��F��Ӧ��Ļ��Һ�м�������KMnO4��Һ�����Һ�Ϻ�ɫ��dz
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2017�츣��ʡ���Ŵ�ѧ���и�����ѧ�ڵڶ����¿�����ͼ��ʾ�ס����ǵ绯ѧʵ��װ�á�

��1�� ���ס������ձ��о�ʢ��NaCl��Һ��
�� ����ʯī���ϵĵ缫��ӦʽΪ______________________________��
�� �����ܷ�Ӧ�����ӷ���ʽΪ________________________________��
�� ��ʪ��ĵ���KI��ֽ�������ձ��Ϸ���������ֽ�ȱ�������ɫ��������Ϊ������Cl2���������ɵ�I2������Ӧ��Cl2��I2�����ʵ���֮��Ϊ5��1�������������ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪ________________________
��2�� ���ס������ձ��о�ʢ��CuSO4��Һ��
�� ���������ϵĵ缫��ӦʽΪ___________________________��
�� �����ʼʱ����ʢ��200 mL pH��5��CuSO4��Һ(25 ��)��һ��ʱ�����Һ��H��Ϊ1����Ҫʹ��Һ�ָ������ǰ��״̬��������Һ�м���__________(��д���ʵĻ�ѧʽ)________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ�ü�����ϩʱ����Ҫ���ӵ���
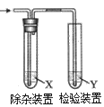
��ϩ���Ʊ� | �Լ�X | �Լ�Y | |
A | CH3CH2Br��NaOH�Ҵ���Һ���� | H2O | KMnO4������Һ |
B | CH3CH2Br��NaOH�Ҵ���Һ���� | H2O | Br2��CCl4��Һ |
C | CH3CH2OH��ŨH2SO4������170�� | NaOH��Һ | KMnO4������Һ |
D | CH3CH2OH��ŨH2SO4������170�� | NaOH��Һ | Br2��ˮ��Һ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com