
分析 (1)根据生成氨气的物质的量,利用物质的量之比等于化学计量数之比计算参加反应的氮气的物质的量,t时刻时氮气的物质的量与参加反应的氮气的物质的量之和为a的值;
(2)计算出混合气体总的物质的量,利用体积分数计算氨气的物质的量;
(3)结合化学平衡三行计算得到的数据计算平衡混合气体中各气体物质的量之比.
解答 解:(1)结合化学平衡三行计算得到,
N2+3H2?2NH3
开始时:a b 0
转化 1.5 4.5 3
t时:6.5 3
在t时生成3 mol NH3,消耗了1.5 mol N2,所以a=6.5+1.5=8,
答:a的值为8;
(2)n(NH3)=$\frac{358.4L}{22.4L/mol}$×25%=16 mol×25%=4 mol,
答:平衡时NH3的物质的量为4mol;
(3)依据(2)的计算可知平衡混合气体中氨气为4mol,则氮气和氢气物质的量=16mol-4mol=12mol,
结合化学平衡三行计算得到,
N2+3H2?2NH3
开始(mol) 8 b 0
转化(mol) 2 6 4
平衡(mol) 6 b-6 4
6+b-6=12
b=12
平衡状态下氢气物质的量=12mol-6mol=6mol,
平衡混合气体中,n(N2):n(H2):n(NH3)=6:6:4=3:3:2,
答:平衡混合气体中,n(N2):n(H2):n(NH3)等于3:3:2;
点评 本题考查化学平衡的计算,题目难度中等,注意利用三段式法结合化学方程式计算,掌握基础是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | Al3+ NH4+ Br- SO42- | B. | Na+ Fe2+ Cl- NO3- | ||
| C. | K+ Ba2+ Cl- NO3- | D. | K+ Na+ SO42- SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
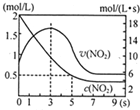 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题: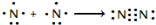 .
.| 化学键 | N-H | N-N | N═N | N≡N | O═O | O-H |
| 键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种难溶电解质,Ksp小的溶解度一定小 | |
| B. | 0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中,所得溶液中c(Cl-)=c(I-) | |
| C. | 在硫酸钡的沉淀溶解平衡体系中加入蒸馏水,硫酸钡的Ksp增大 | |
| D. | 用锌片作阳极,铁片作阴极,电解ZnCl2溶液,铁片表面出现一层锌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g).已知938K时平衡常数K=1.47,1173K时平衡常数K=2.15.
有可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g).已知938K时平衡常数K=1.47,1173K时平衡常数K=2.15.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com