
科目:高中化学 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列离子方程式中正确的是
A.用Pt电极电解少量的CuC12溶液:2H2O+Cu2++2Cl- 通电 H2↑+C12↑+Cu(OH)2↓
B.0.01 mol/L NH4Al(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
C.酸性高锰酸钾溶液中滴加H2O2溶液4MnO4- + 4H2O2 + 12H+ = 4Mn2+ + 7O2↑+ 10H2O
D.向磁性氧化铁中加入氢碘酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源:四川省广安、遂宁、内江、眉山四市2017届高三第二次诊断考试理综化学试卷 题型:填空题
氯化亚铜广泛应用于有机合成。工业上以低品位铜矿(主要含CuS、Fe2O3、SiO2)为原料,
制备氯化亚铜的生产工艺如下:
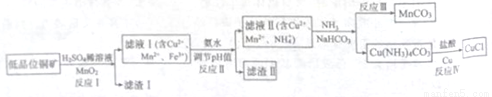
(1)CuS中Cu的化合价为_____________。
(2)滤渣Ⅰ的成分除S之外还有__________,反应Ⅰ中MnO2的作用是______________
(3)已知生成氢氧化物的pH如下表:
沉淀物 | Fe(OH)3 | Mn(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.7 | 8.3 | 4.2 |
完全沉淀的pH | 3.2 | 9.8 | 6.7 |
则反应Ⅱ中用氨水调节pH值的范围是________________。
(4)检验滤液Ⅱ中是否含有Fe3+的试剂是____________。
(5)请用化学用语回答:
①反应中Ⅲ生成难溶MnCO3的离子方程式_____________;
②反应Ⅳ素所对应的化学方程式____________________。
(6)氯化亚铜的定量分析:
步骤Ⅰ.称取0.2500g的样品和10.0mL 1.0mol/L的FeCl3溶液置于250mL锥形瓶中,不断摇动;
步骤Ⅱ.待样品溶解后,加水10.0mL和3滴指示剂;
步骤Ⅲ.用0.1000mol/L CeOSO4标准溶液滴至终点,并记录读数。重复实验两次,测得数据如下:
序号 | 1 | 2 | 3 |
起始读数 | 0.95mL | 0.70mL | 1.00mL |
终点读数 | 20.95mL | 24.95mL | 21.00mL |
已知:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+
①数据处理:计算CuCl纯度________________;
②误差分析:下列操作会使滴定结果偏高的是__________________。
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线,其他操作正确
C.0.1000mol/L CeOSO4溶液久置后浓度变小
D.滴定前滴定管尖嘴有气泡,滴定后气泡消失
E.所取FeCl3溶液体积偏大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省南宁市高一下学期第一次月考化学试卷(解析版) 题型:选择题
在标准状况下,将O2与NO按3:4体积比充满烧瓶,将烧瓶倒置于水中,最后烧瓶内溶液的物质的量浓度约为(单位:mol·L-1)
A. 0.045 B. 0.036 C. 0.026 D. 0.018
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省南宁市高一下学期第一次月考化学试卷(解析版) 题型:选择题
某同学用下图装置及药品进行酸性强弱的实验,下列说法不正确的是

A. ①和②中发生的反应均为复分解反应
B. 若将实验中的稀硫酸换成稀盐酸也能比较三种酸强弱
C. 一段时间后②中有胶冻状物质生成
D. 该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(五)化学 试卷(解析版) 题型:简答题
钒和镍及其化合物是重要的催化剂和合金材料。
(1)基态V原子的价层电子排布式为________,其中排布时能量最高的电子所占据能级的原子轨道有________个仲展方向。
(2)VO2+与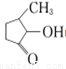 可形成配合物。
可形成配合物。 中,三种非金属原子的第一电离能由大到小的顺序为________(用元素符号表示);C原子的杂化轨道类型为_________。
中,三种非金属原子的第一电离能由大到小的顺序为________(用元素符号表示);C原子的杂化轨道类型为_________。
(3)镍形成的[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子中N原子的价层电子对数目为______。与CN-互为等电子体的一种分子的化学式为__________。
(4)La-Ni合金是重要的储氢材料,储氢后的晶胞如图所示。
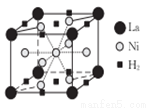
①合金中,1个La原子周围距离最近且相等的La原子数目为_______。
②含有1mol Ni原子的合金中储存H2的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(五)化学 试卷(解析版) 题型:选择题
25℃时,0. molNa2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是( )

A. W点所示的溶液中:c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
B. pH=14的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1mol/L
C. pH=8的溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-)
D. pH=11的溶液中:c(Na+)+ c(H+)=c(OH-)+c(Cl-)+c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源:天津市红桥区2017届高三一模化学试卷 题型:填空题
X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中第________周期,第______族;
(2)X可形成双原子分子,其分子的电子式是_________;Y和氢元素形成的10电子微粒中常见+1价阳离子为_______(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式__________。
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式_________________________。
(4)将0.20molYZ2和0.10molO2充入一个固定容积为5L的密闭容器中,在一定温度并有催化剂存在下,进行反应,经半分钟达到平衡,测得溶液中含YZ30.18mol,则v(O2)=________mol/(L·min);若温度不变,继续通入0.20molYZ2和0.10molO2,则平衡_______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(YZ3)<_______mol。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一下学期第一次(3月)阶段检测化学试卷(解析版) 题型:选择题
某充电电池的原理如图所示,溶液中c(H+)=2.0mol·L-1,阴离子为SO42-,a、b均为情性电极,充电时右槽溶液颜色由绿色变为紫色。下列对此电池叙述正确的是( )

A. 放电过程中,左槽溶液颜色由黄色变为蓝色
B. 充电过程中,a极的反应式为:VO2++2H++e-=VO2++H2O
C. 充电时,b极接直流电源正极,a极接直流电源负极
D. 放电时,当转移1.0mol电子时共有2.0molH+从左槽迁移进右槽
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com