
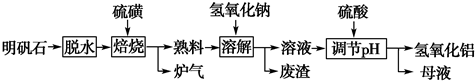
| ||
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
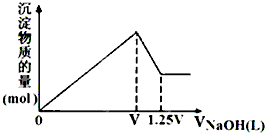 有MgSO4、AlCl3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中Cl-与SO42-的物质的量浓度之比为( )
有MgSO4、AlCl3的混合溶液,向其中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则溶液中Cl-与SO42-的物质的量浓度之比为( )| A、1:1 | B、2:3 |
| C、3:1 | D、6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| M | |||||||
| X | Y | Z | |||||
| W |
| A、Y、M形成的气态化合物在标准状况下的密度为0.76 g.L-1 |
| B、原子半径:W>Z>Y>X>M |
| C、由X元素形成的单质一定是原子晶体 |
| D、XZ2、X2M2、W2Z2均为直线型的共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、221 kJ |
| B、557 kJ |
| C、242 kJ |
| D、188 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
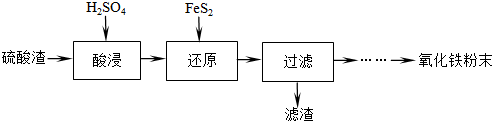
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 |
| B、配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 |
| C、草木灰可以与铵态氮肥混合使用 |
| D、高铁酸钠(Na2FeO4)能应用于饮用水消毒并净化水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
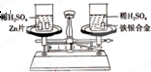 如图所示,在托盘天平的左右两托盘中各放置一只烧杯,调节天平使之平衡,向烧杯中分别注入足量且等质量、等浓度的稀硫酸,然后向两只烧杯中分别加入相同质量的锌片和铁银合金,反应完成后,天平仍保持平衡.合金中铁和银的质量比为( )
如图所示,在托盘天平的左右两托盘中各放置一只烧杯,调节天平使之平衡,向烧杯中分别注入足量且等质量、等浓度的稀硫酸,然后向两只烧杯中分别加入相同质量的锌片和铁银合金,反应完成后,天平仍保持平衡.合金中铁和银的质量比为( )| A、65:56 | B、56:108 |
| C、56:9 | D、65:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com