
 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:| 50℃ |
| 230℃ |
| 50℃ |
| (100-41)g×98.5% |
| 59g/mol |
| ||
| 10min |


科目:高中化学 来源: 题型:
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
(1)Ni(S)+4CO(g)![]()
![]() Ni(CO)4(g)+Q
Ni(CO)4(g)+Q
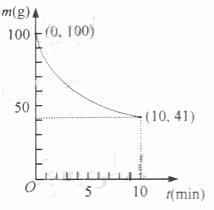
(2)Ni(CO)4(g) ![]() Ni(S)+4CO(g)
Ni(S)+4CO(g)
完成下列填空:
31.在温度不变的情况下,要提高反应(1)中Ni(CO4)的产率,可采取的措施有 、
。
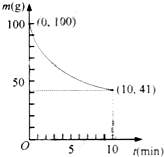
32.已知在一定条件下的2L密闭容器中制备Ni(CO)4,粗镍(纯度98.5%,所含杂质不与CO反应)剩余质量和反应时间的关系如右图所示。Ni(CO)4在0~10min的平均反应速率为
。
33.若反应(2)达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 。
a.平衡常数K增大 b.CO的浓度减小
c.Ni的质量减小 d.v逆[Ni(CO)4]增大
34.简述羰基法提纯粗镍的操作过程。
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试化学(上海卷带解析) 题型:填空题
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
(1)Ni(S)+4CO(g)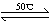 Ni(CO)4(g)+Q
Ni(CO)4(g)+Q
(2)Ni(CO)4(g) 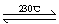 Ni(S)+4CO(g)
Ni(S)+4CO(g)
完成下列填空:
(1)在温度不变的情况下,要提高反应(1)中Ni(CO4)的产率,可采取的措施有 、 。
(2)已知在一定条件下的2L密闭容器中制备Ni(CO)4,粗镍(纯度98.5%,所含杂质不与CO反应)剩余质量和反应时间的关系如右图所示。Ni(CO)4在0~10min的平均反应速率为 。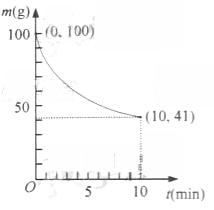
(3)若反应(2)达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 。
a.平衡常数K增大 b.CO的浓度减小
c.Ni的质量减小 d.v逆[Ni(CO)4]增大
(4)简述羰基法提纯粗镍的操作过程。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省梅州市高三3月总复习质检理综化学试卷(解析版) 题型:填空题
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
反应Ⅰ? Ni(S)+4CO(g)
 Ni(CO)4(g)△H1<0
Ni(CO)4(g)△H1<0
反应Ⅱ? Ni(CO)4(g)  Ni(S)+4CO(g) △H2??
Ni(S)+4CO(g) △H2??
(1)在温度不变的情况下,要提高反应Ⅰ中Ni(CO)4的产率,可采取的措施有???????? 、??????? 。
(2)已知350K下的2L密闭容器中装有100g粗镍(纯度98.5%,所含杂质不与CO反应),通入6 molCO气体发生反应Ⅰ制备Ni(CO)4,容器内剩余固体质量和反应时间的关系如图所示,10min后剩余固体质量不再变化。
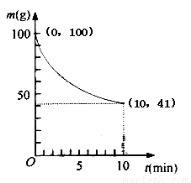
①反应Ⅰ在0~10min的平均反应速率v(Ni(CO)4)= ??????????????? 。
②若10min达到平衡时在右端得到29.5g纯镍,则反应Ⅰ的平衡常数K1为多少?(写出计算过程)
(3)反应Ⅱ中 △H2 ?? 0(填“>”、“<”、“=”);若反应Ⅱ达到平衡后,保持其他条件不变,降低温度,重新达到平衡时???????? 。(双选)
a.平衡常数K增大?? b.CO的浓度减小??? c.Ni的质量减小??? d.v逆[Ni(CO)4]增大
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M? 电池充电时,阳极的电极反应式为????????????????????????????????? 。电池充电时阴极上发生?????? (填“氧化”或“还原”)反应
Ni(OH)2+M? 电池充电时,阳极的电极反应式为????????????????????????????????? 。电池充电时阴极上发生?????? (填“氧化”或“还原”)反应
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试化学(上海卷解析版) 题型:填空题
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
(1)Ni(S)+4CO(g)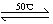 Ni(CO)4(g)+Q
Ni(CO)4(g)+Q
(2)Ni(CO)4(g) 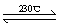 Ni(S)+4CO(g)
Ni(S)+4CO(g)
完成下列填空:
(1)在温度不变的情况下,要提高反应(1)中Ni(CO4)的产率,可采取的措施有 、 。
(2)已知在一定条件下的2L密闭容器中制备Ni(CO)4,粗镍(纯度98.5%,所含杂质不与CO反应)剩余质量和反应时间的关系如右图所示。Ni(CO)4在0~10min的平均反应速率为 。
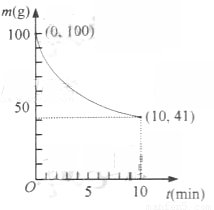
(3)若反应(2)达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 。
a.平衡常数K增大 b.CO的浓度减小
c.Ni的质量减小 d.v逆[Ni(CO)4]增大
(4)简述羰基法提纯粗镍的操作过程。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com