
| 充电 |
| 放电 |
| A、该电池反应为可逆反应 |
| B、放电时,Li+向负极移动 |
| C、充电时,阴极反应式为Li++e-?Li |
| D、该电池内可以换成LiBr的水溶液 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 锂离子电池已经成为应用最广泛的可充电电池.某种锂离子电池的结构示意图:其中两极区间的隔膜只允许Li+通过.电池充电时的总反应化学方程式为:LiC002=Li1-xC002+xLi.关于该电池的推论错误的是( )
锂离子电池已经成为应用最广泛的可充电电池.某种锂离子电池的结构示意图:其中两极区间的隔膜只允许Li+通过.电池充电时的总反应化学方程式为:LiC002=Li1-xC002+xLi.关于该电池的推论错误的是( )查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
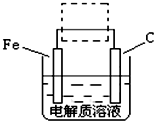 (FeSO4?7H2O)一起净水,其原理为
(FeSO4?7H2O)一起净水,其原理为 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH 溶液的pH为
溶液的pH为查看答案和解析>>
科目:高中化学 来源: 题型:
 锂离子电池已经成为应用最广泛的可充电电池.某种锂离子电池的结构示意图:其中两极区间的隔膜只允许Li+通过.电池充电时的总反应化学方程式为:LiC002=Li1-xC002+xLi.关于该电池的推论错误的是( )
锂离子电池已经成为应用最广泛的可充电电池.某种锂离子电池的结构示意图:其中两极区间的隔膜只允许Li+通过.电池充电时的总反应化学方程式为:LiC002=Li1-xC002+xLi.关于该电池的推论错误的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
| A、因为LiI在水中的溶解度比在有机溶剂中大,所以选用水溶液做电解质 | |||
B、电池反应方程式为2Li+I2
| |||
| C、电池的负极为I2 | |||
| D、充电时,阳极反应为2LiI→Li+2I-+2e- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com