
下列物质中既能与稀H2SO4反应,又能与NaOH溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3.
A. ③④ B. ①②③④ C. ①③④ D. 全部
考点: 铝的化学性质;镁、铝的重要化合物.
专题: 几种重要的金属及其化合物.
分析: 既能与稀H2SO4反应,又能与NaOH溶液反应的物质有铝、氧化铝、氢氧化铝、多元弱酸的酸式盐,弱酸对应的铵盐、蛋白质、氨基酸等.
解答: 解:①NaHCO3与稀H2SO4反应生成硫酸钠、水和二氧化碳,与NaOH溶液反应生成碳酸钠和水,故①正确;
②Al2O3与稀H2SO4反应生成硫酸铝和水,与NaOH溶液反应生成偏铝酸钠和水,故②正确;
③Al(OH)3与稀H2SO4反应生成硫酸铝和水,与NaOH溶液反应生成偏铝酸钠和水,故③正确;
④Al与稀H2SO4反应生成硫酸铝和氢气,与NaOH溶液反应生成偏铝酸钠和氢气,故④正确;
⑤Na2CO3与稀H2SO4反应生成硫酸钠、水和二氧化碳,与NaOH溶液反应不反应,故⑤错误;
故选B.
点评: 本题考查既能与酸又能与碱反应的物质,明确Al、Al2O3、Al(OH)3的性质是解答本题的关键,并注意归纳常见物质的性质来解答.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
单质与浓硝酸混合,出现的情况依次为:①反应生成相应的硝酸盐;②反应生成最高价含氧酸;③常温下单质发生钝化;④不发生反应.符合上述要求的单质组是( )
|
| A. | Cu、C、Zn、Au | B. | Si、P、Al、Pt | C. | Fe、C、Pt、Hg | D. | Cu、S、Fe、Au |
查看答案和解析>>
科目:高中化学 来源: 题型:
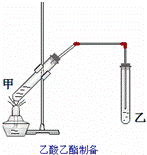
如图在试管甲中先加入2mL乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5mL饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
(1)该实验中长导管的作用是 ,其不宜伸入试管乙的溶液中,原因是 .
(2)试管乙中饱和Na2CO3的作用是①除去乙酸乙酯中的乙醇和乙酸,② .
(3)试管乙中观察到的现象是 .
(4)试管甲中加入浓硫酸的目的是①催化剂,吸水剂② 酸 .
(5)液体混合加热时液体体积不能超过试管容积的 ,本实验反应开始时用小火加热的原因是 ;(填字母)
a.加快反应速率
b.防止了反应物未来得及反应而挥发损失
(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
查看答案和解析>>
科目:高中化学 来源: 题型:
磁流体是电子材料的新秀,它既有固体的磁性,又有液体的流动性,制备时将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可产生黑色的、分散质粒子的直径为55nm~36nm的磁流体,下列说法中正确的是( )
A. 所得到的分散系为浊液
B. 该分散系的分散质为Fe(OH)3
C. 用一束光照射该分散系,可以看到一条光亮的“通路”
D. 该分散系极不稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子在溶液中能大量共存的是( )
A. H+、A1O2﹣、Na+、Cl﹣
B. 强碱性溶液:Na+、HCO3﹣、SO42﹣
C. Fe2+、Fe3+、Na+、NO3﹣
D. Fe2+、NH4+、Cl﹣、OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C是三种元素的原子,质子数都小于18.A原子与B原子的最外层电子数都是6,A原子与C原子的核外电子层数都为3,C原子的质子数比A少4.回答下列问题:
(1)A、B、C的元素符号分别为 、 、 .
(2)A的离子结构示意图为 ;A与C组成的化合物电子式为 .
(3)元素A的一种质量数为32的核素,与元素B的一种核素构成微粒为AB42﹣,1mol AB42﹣的质量为104g,则元素B的该核素中的中子数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
如图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
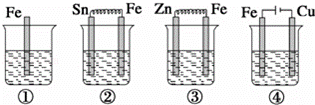
|
| A. | ③>②>④>① | B. | ②>①>③>④ | C. | ④>②>③>① | D. | ④>②>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
某种镁矿石的主要成分是碳酸镁,还含有较多的脉石(SiO2)和少量石灰石.图1所示是利用该镁矿石制备七水硫酸镁(MgSO4•7H2O)的工艺流程,图2是CaSO4和MgSO4的溶解度曲线.
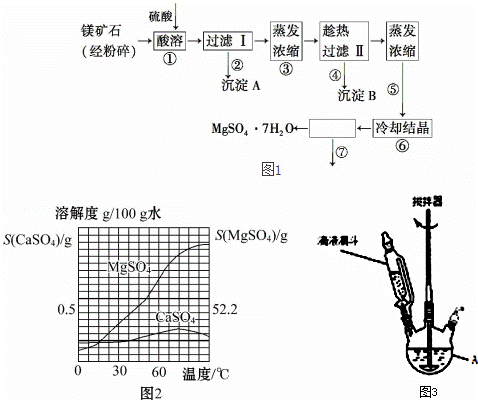
根据以上信息回答下列问题:
(1)步骤①可在图3装置中进行,仪器A的名称是 ,硫酸要分批缓慢加入的原因是 防 ,矿石要粉碎和反应过程中不断搅拌的主要目的是 ,碳酸镁与硫酸反应的化学方程式 .
(2)沉淀A的成分是SiO2和少量的 ,
(3)上述流程中多次用到了过滤操作,实验室过滤时需要用到的玻璃仪器是玻璃棒、烧杯和 .步骤④趁热过滤的作用是 .
(4)步骤⑦的操作名称是过滤、 、 .过滤操作时需将步骤⑥中冷却结晶后的溶液和晶体转移到漏斗中,最后器壁上往往还沾有少量晶体,需选用一种液体将器壁上的晶体淋洗并倾入漏斗中,下列液体最合适的是
A.冰水 B.滤液 C.稀硫酸 D.无水乙醇
(5)步骤⑦中洗涤晶体时,先冰水洗,后用酒精洗,用冰水洗的目的:①除去晶体表面的硫酸等杂质,② ,用酒精洗的目的是
(6)步骤⑦不宜采用加热干燥的方法,可能的原因是 .
(7)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④至恒重,⑥计算.步骤③需要在干燥器中进行,理由是 ;步骤⑤的目的是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com