
| A. | 20℃时,将锌片放入0.01 mol•L-1的稀盐酸中 | |
| B. | 20℃时,将锌片放入0.1 mol•L-1的稀盐酸中 | |
| C. | 50℃时,将锌片放入0.01 mol•L-1的稀盐酸中 | |
| D. | 50℃时,将锌片放入0.1 mol•L-1的稀盐酸中 |
科目:高中化学 来源: 题型:解答题
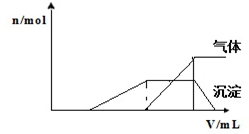 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | H+ NH4+ Al3+ K+ |
| 可能大量含有的阴离子 | Cl- Br- I?ClO? AlO2- |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(X-) | 1.25mol | 1.5mol | 2mol |
| n(Y-) | 1.5mol | 1.4mol | 0.9mol |
| n(Z-) | amol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
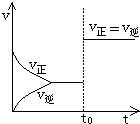 可逆反应aA(g)+bY(g)?cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)的图象图如图所示,下列说法正确的是( )
可逆反应aA(g)+bY(g)?cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)的图象图如图所示,下列说法正确的是( )| A. | 只能通过加入催化剂实现 | B. | 可能通过增大压强来实现 | ||
| C. | 可能通过升高温度实现 | D. | a+b一定不等于c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
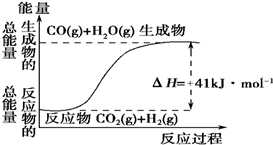
| A. | 其热化学方程式为:CO(g)+H2O(g)═CO2(g)+H2(g)△H=41kJ•mol-1 | |
| B. | 该反应为吸热反应 | |
| C. | 该反应为放热反应 | |
| D. | 若当H2O为液态时反应热为△H2,则△H2>△H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥⑦ | B. | ④⑥ | C. | ①④⑤⑧ | D. | ④⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
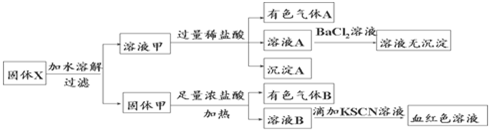
| A. | 溶液甲中一定含有K2SiO3、NaNO2、可能含有KAlO2、K2CO3 一定不含有K2SO3 | |
| B. | 沉淀A为H2SiO3 | |
| C. | 气体A和气体B一定均为纯净物 | |
| D. | 原混合物中一定含有Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 丙烷分子中3个碳原子一定在同一条直线上 | |
| B. | 丙烯分子中3个碳原子都在同一平面 | |
| C. | 乙烷分子中碳原子和全部氢原子可能在同一平面上 | |
| D. | 2-丁烯分子中4个碳原子在同一平面上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com