
下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
| 选项 | A | B | C | D |
| 物质 | MgCl2 | CO2 | HCl | NaOH |
| 所含化学 键类型 | 离子键、 共价键 | 共价键 | 离子键 | 离子键、 共价键 |
| 所属化合 物类型 | 离子 化合物 | 共价 化合物 | 离子 化合物 | 共价 化合物 |
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
下图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )
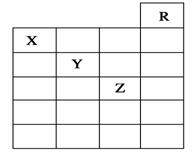
①X的气态氢化物与Y最高价氧化物对应的水化物的溶液能发生反应生成盐
②同浓度的Y、Z的气态氢化物的水溶液的酸性Y<Z
③Z的单质常温下是液体,可与铁粉反应
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素
A.只有③ B.只有①④
C.只有①②③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
钒有金属“维生素”之称,研究发现钒的某些化合物对治疗糖尿病有很好的疗效。
工业上设计将VOSO4中的K2SO4、SiO2、CuO杂质除去并回收得到V2O5的流程如下:

请回答下列问题:
(1)步骤②、③的变化过程可表示为(HM为有机萃取剂):
VOSO4 (水层)+ 2HM(有机层) VOM2(有机层) + H2SO4 (水层)
VOM2(有机层) + H2SO4 (水层)
步骤②中萃取时必须加入适量碱,其原因是 。
步骤③中X试剂为 。
(2)步骤④的离子方程式为
(3)该工艺流程中,可以循环利用的物质有 和 。
(4)操作Ⅰ得到的废渣,用 溶解,充分反应后, ,(填写系列操作名称)称量得到mg氧化铜。
(5)为了制得氨水,甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
实验装置 | 实验药品 | 制备原理 | |
甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为① |
乙小组 | ② | 浓氨水、氢氧化钠固体 | 分析产生氨气的原因③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
将铁片和银片用导线连接置于同一稀盐酸溶液中,并经过一段时间后,下列叙述正确的
A.负极有Cl2逸出,正极有H2逸出 B.负极附近Cl-的浓度减小
C.正极附近Cl-的浓度逐渐增大 D.溶液中Cl-的浓度基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中发生反应2SO2+O2  2 SO3,当其他条件不变时,只改变一个条件,将生成SO3的反应速率的变化填入下表格里(填“增大”、“减小”或“不变”)。
2 SO3,当其他条件不变时,只改变一个条件,将生成SO3的反应速率的变化填入下表格里(填“增大”、“减小”或“不变”)。
| 编号 | 改变的条件 | 生成的SO3的速率 |
| (1) | 升高温度 | |
| (2) | 充入一定量N2 | |
| (3) | 减少SO3的浓度 | |
| (4) | 使用催化剂 | |
| (5) | 压缩体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应2SO2(g) + O2(g)  2SO3(g),下列变化可增大活化分子百分数从而使反应速率加快的是( )
2SO3(g),下列变化可增大活化分子百分数从而使反应速率加快的是( )
①增大压强 ②升高温度 ③增大O2浓度 ④使用正催化剂
A.①③ B.①④ C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个温度恒定的密闭容器中,SO2和O2发生反应。已知1mol SO2和足量O2完全反应,放出热量为Q。请按要求回答下列问题:
【恒温恒压条件下】
(1)若开始放入1mol SO2和0.5mol O2,达到平衡后,生成0.9mol SO3。这时SO2的转化率为__________________________。
(2)若开始时放入4mol SO2和2mol O2,达到平衡时,生成SO3的物质的量为___________,反应放出的热量为____________________。
【恒温恒容条件下】
(3)若开始放入1mol SO2和0.5mol O2,达到平衡后,生成a mol SO3,则a_________0.9mol(填“>”、“<”或“=”)
(4)若另X、Y、Z分别代表初始加入SO2、O2和SO3的物质的量,要使其达到平衡时,反应混合物中三种气体的物质的量分数与(3)中平衡时完全相同,则X、Y、Z必须满足的一般条件是______________________、__________________________。(用两个代数式表示,其中一个只含X、Y,另一个含X、Z)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于丙烷的说法不正确的是( )
A.丙烷的沸点比甲烷高
B.丙烷可与氯气发生取代反应
C.丙烷可以使酸性高锰酸钾溶液褪色
D.丙烷的一氯代物有两种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com