
 2AB(g) 在一定条件下,达到平衡状态的标志是( )
2AB(g) 在一定条件下,达到平衡状态的标志是( )| A.单位时间内,生成n mol A2的同时,生成n mol的B2 |
| B.单位时间内生成2n mol AB的同时,生成n mol的B2 |
| C.平衡时容器内的总压强不随时间而变化 |
| D.平衡时容器内各物质的物质的量比为1∶1∶2 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
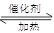 2SO3(g),已知c(SO2)始=0.4 mol·L-1,c(O2)始=1 mol·L-1,经测定该反应在该温度下的平衡常数K=19,则此反应中SO2的转化量为 ( )
2SO3(g),已知c(SO2)始=0.4 mol·L-1,c(O2)始=1 mol·L-1,经测定该反应在该温度下的平衡常数K=19,则此反应中SO2的转化量为 ( )| A.0.24 mol·L-1 | B.0.28 mol·L-1 |
| C.0.32 mol·L-1 | D.0.26 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
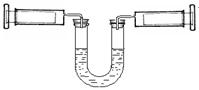
| A.左侧气体颜色先变深后逐渐变浅 |
B.对于2NO2 N2O4平衡体系 ,向生成N2O4的方向移动 N2O4平衡体系 ,向生成N2O4的方向移动 |
| C.压缩后U型管内两侧液面仍然保持水平 |
| D.若将两侧注射器活塞重新拉到10mL的位置,平衡后U型管两侧液面仍然保持水平 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有① | B.只有①② | C.只有①③ | D.①②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(气) + 2D(气),平衡时C的含量为m% ,保持温度不变,若按下列配比的物质放入容器中,达平衡时,C的含量仍为m%的是
C(气) + 2D(气),平衡时C的含量为m% ,保持温度不变,若按下列配比的物质放入容器中,达平衡时,C的含量仍为m%的是| A.2molA和1molB | B.2molD和1mol A 和 1molB |
| C.1molC和2molD 和1molB | D.1molC和1molD |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 110 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2(g) + Br2(g) (正反应为吸热反应) 达到化学平衡时,要使混合气体的颜色加深,可采取的方法是
H2(g) + Br2(g) (正反应为吸热反应) 达到化学平衡时,要使混合气体的颜色加深,可采取的方法是| A.减小压强 | B.缩小体积 |
| C.降低温度 | D.增大氢气的浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ?CH3OH(g)。
?CH3OH(g)。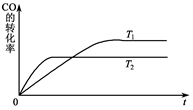
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com