
【题目】已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g)(正反应为放热反应).现将一定量NO2和N2O4的混合气体通入一体积为2L的恒温密闭容器中,反应物物质的量随时间变化关系如图所示,则下列说法错误的是( )
A.前10min内用NO2表示的化学反应速率v(NO2)=0.02mol/(Lmin)
B.反应进行至25min时,曲线发生变化的原因可以是向容器中添加NO2(g)
C.若要达到与最后相同的化学平衡状态,在25min时还可以采取的措施是添加N2O4(g)
D.a、b、c、d四个点中,表示化学反应处于平衡状态的点成是b和d
【答案】A
【解析】由图可知0﹣10min平衡状态时,X曲线△c=(0.6﹣0.2)mol/L=0.4mol/L,Y曲线△c=(0.6﹣0.4)mol/L=0.2mol/L,X曲线浓度变化量是Y曲线浓度变化量的2倍,则X曲线表示NO2浓度随时间的变化曲线,Y曲线表示N2O4浓度随时间的变化曲线;反应时NO2浓度增大,N2O4浓度减小,说明反应逆向进行;
A.前10min内用NO2表示的化学反应速率v(NO2)= ![]() =
= ![]() =0.04mol/(Lmin),A符合题意;
=0.04mol/(Lmin),A符合题意;
B.反应进行至25min时,c(NO2)增大、c(N2O4)不变,所以改变的条件可能是向容器中添加NO2(g),B不符合题意;
C.若要达到与最后相同的化学平衡状态,在25min时还可以增大生成物平衡逆向移动来实现,C不符合题意;
D.如果各物质的浓度不变时,该可逆反应达到平衡状态,根据图知,bd点各物质浓度不变,说明正逆反应速率相等,反应达到平衡状态,D不符合题意;
故答案为:A.
图像题一定要注意横轴与纵轴对应的物理量,结合化学定律进行分析。A.v(NO2)= ![]() 可由图像得出△ c 与 △ t;B.反应进行至25min时,c(NO2)突变而c(N2O4)不变是关键;C.因该反应的特点是反应物与生成物均为一种,加入反应物和加入生成物可达到相同的平衡状态;D.平衡状态时各物质浓度不变。
可由图像得出△ c 与 △ t;B.反应进行至25min时,c(NO2)突变而c(N2O4)不变是关键;C.因该反应的特点是反应物与生成物均为一种,加入反应物和加入生成物可达到相同的平衡状态;D.平衡状态时各物质浓度不变。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】有机物D,质谱图表明其相对分子质量为86,将8.6gD完全燃烧的产物依次通过装有浓硫酸和碱石灰的装置,浓硫酸中增重9g,碱石灰中增重22g.其相关反应如图所示,其中B、D、E的结构中均含有2个﹣CH3 , 它们的核磁共振氢谱中均出现4个峰.
请回答:
(1)B中所含官能团的名称为;D的分子式为;
(2)Ⅲ的反应类型为(填字母序号);
a.还原反应 b.加成反应 c.氧化反应 d.消去反应
(3)写出下列反应的化学方程式:
Ⅰ:;
Ⅳ﹣:;
(4)C和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为;
(5)A的同分异构体中有一对互为顺反异构,且结构中有2个﹣CH3 , 它们的结构简式为和;
(6)E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的.主要步骤如下:
下列说法不正确的是( )
A. 为使海水中的MgSO4转化成Mg(OH)2,试剂①可选择石灰乳
B. 加入试剂①后,分离得到Mg(OH)2沉淀的方法是过滤
C. 加入试剂②反应的离子方程式为:OH﹣+H+=H2O
D. 通过电解熔融的无水MgCl2得到48gMg,共转移4mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--物质结构与性质]世上万物,神奇可测。其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题:
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是____(填标号)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同-一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为_____,Q2+的未成对电子数是_____.
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①铜元素在周期表中的位置是______, [Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为_______。
②[Cu(NH3)4]SO4中,存在的化学键的类型有_____(填标号)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
③NH3中N原子的杂化轨道类型是_____,写出一种与SO42-互为等电子体的分子的化学式:_____________。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为_____________。
(4)CuO晶胞结构如图所示。

该晶体的密度为ρg/cm3,则该晶体内铜离子与氧离子间的最近距离为_____ (用含ρ的代数式表示,其中阿伏加德罗常数用NA表示)cm。
(5)在Cu2O晶胞结构中,Cu处于正四面体空隙,O处于_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )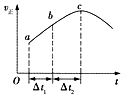
A.反应物的总能量低于生成物的总能量
B.△t1=△t2时,CO的转化率:a~b段小于bc段
C.反应在c点达到平衡状态
D.反应物浓度:a点小于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常采用N2(g)和H2(g)崔华成NH3(g):N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1
(1)在一定温度下,若将10amolN2和30amolH2放入2L的密闭容器中,充分反应后测得平衡时N2的转化率为60%,则该反应的平衡常数为(用含a的代数式表示).若此时再向该容器中投入10amolN2、20amolH2和20amolNH3 , 判断平衡移动的方向是(填“正向移动”“逆向移动”或“不移动”).
(2)若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L.则NH3达到平衡时浓度的范围为;若平衡时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,则NH3起始时浓度的范围为 .
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 | |
平衡时数据 | 反应能量变化的绝对值(kJ) | Q1 | Q2 | Q3 |
反应物转化率 | a1 | a2 | a3 | |
体系压强(Pa) | p1 | P2 | P3 | |
则Q1+Q2=kJ;a1+a2l(填“<”“>”或“=”下同):2p2p3
(4)如图:A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2 , 将1molN2和3molH2通过K3充入B中,将2molN2和6molH2通过K1充入A中;起始时A、B的体积相同均为1L,达到平衡时,V(B)=0.9L;然后打开K2 , 一段时间又达到平衡时,B的体积为L(连通管中气体体积不计).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型有机酰胺化合物M在工业生产中有重要的应用,其合成路线如下:

已知以下信息:
①A的相对分子质量为58,含氧的质量分数为0.552,已知核磁共振氢谱显示为一组峰,可发生银镜反应。
② ![]()
③R—COOH ![]() R—COCl
R—COCl
④
⑤
请回答下列问题:
(1)A的名称为____________,B中含有官能团名称为_____________。
(2)C→D的反应类型为__________________,生成G的“条件a”指的是___________________。
(3)E的结构简式为___________________。
(4)F+H→M的化学方程式为____________________________。
(5)芳香族化合物W有三个取代基,与C互为同分异构体,当W分别与Na、NaOH充分反应时,1mol W最多可消耗的Na、NaOH分别为2 mol、1mol。试分析W共有________种同分异构体,每一种同分异构体的核磁共振氢谱中有____________组峰。
(6)参照上述合成路线,以C2H4和HOCH2CH2OH为原料(无机试剂任选),设计制备 的合成路线___________________。
的合成路线___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在400℃和2633kPa下,将1.5mol氙气(Xe)和6mol氟气(F2)混合,充分反应后冷却至室温,得到一种无色晶体并只剩余3mol氟气,则所得无色晶体产物中,氟与氙的原子个数之比是
A.6:1B.4:1C.3:1D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解食盐水的原理是:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。成品碱中含有氯化钠杂质,可通过分光光度法测定每克成品碱中氯化钠的含量,其测量值(吸光度A)与每克成品碱中氯化钠含量的关系如下图,氯化钠杂质小于0.0050%的成品碱为优品级。下列说法不正确的是
2NaOH+H2↑+Cl2↑。成品碱中含有氯化钠杂质,可通过分光光度法测定每克成品碱中氯化钠的含量,其测量值(吸光度A)与每克成品碱中氯化钠含量的关系如下图,氯化钠杂质小于0.0050%的成品碱为优品级。下列说法不正确的是

A. 吸光度A的值越大,样品中氯化钠含量越小
B. 分光光度法是对物质组成进行定性和定量的测定
C. 图中G点所测的成品碱不是优品级
D. 成品碱是否含有NaCl,可用硝酸酸化的硝酸银溶液检验
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com