

 ,A和氯气反应生成B,则B发生消去反应生成
,A和氯气反应生成B,则B发生消去反应生成 ,所以B的结构简式为
,所以B的结构简式为 ,则A和氯气发生加成反应生成B,
,则A和氯气发生加成反应生成B, 和溴发生1,4加成反应生成
和溴发生1,4加成反应生成 ,
, 和氢氧化钠的水溶液发生取代反应生成C
和氢氧化钠的水溶液发生取代反应生成C ,
, 和氢气发生加成反应生成
和氢气发生加成反应生成 ,据此分析解答.
,据此分析解答. ,A和氯气反应生成B,则B发生消去反应生成
,A和氯气反应生成B,则B发生消去反应生成 ,所以B的结构简式为
,所以B的结构简式为 ,则A和氯气发生加成反应生成B,
,则A和氯气发生加成反应生成B, 和溴发生1,4加成反应生成
和溴发生1,4加成反应生成 ,
, 和氢氧化钠的水溶液发生取代反应生成C
和氢氧化钠的水溶液发生取代反应生成C ,
, 和氢气发生加成反应生成
和氢气发生加成反应生成 .
. 、
、 、
、 ,故答案为:
,故答案为: 、
、 ;
; ;
; +Cl2
+Cl2| 光照 |
 +HCl;
+HCl;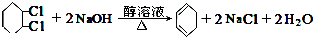 ,
, +Cl2
+Cl2| 光照 |
 +HCl;
+HCl;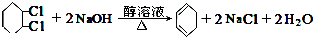 ;
;


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量的氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、将铜屑加入Fe3+溶液中:2Fe3++Cu═2Fe2++Cu2+ |
| C、向硫酸氢钠溶液中滴入氢氧化钡溶液至中性H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D、石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol二氧化碳和1mol氯化氢 |
| B、1g氢气和16g氧气 |
| C、1mol一氧化碳和44g二氧化碳 |
| D、18g水和28g一氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能燃烧生成二氧化碳和水 |
| B、能与溴水发生加成反应 |
| C、能与酸性KMnO4溶液发生氧化反应 |
| D、能与HCl反应生成氯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组在做Na2O2与水反应实验时,发现Na2O2与水反应后的溶液中滴加酚酞试液溶液呈现红色,但红色很快褪色,甲、乙、丙三同学对此现象分别做了如下推测:
某研究性学习小组在做Na2O2与水反应实验时,发现Na2O2与水反应后的溶液中滴加酚酞试液溶液呈现红色,但红色很快褪色,甲、乙、丙三同学对此现象分别做了如下推测:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com