
| A. | 在常温下,放热反应一般能自发进行,吸热反应都不能自发进行 | |
| B. | NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 氯化钴溶液中存在平衡: [Co(H2O)6]2+(粉红色)+4Cl-?[CoCl4]2-(蓝色)+6H2O;△H=akJ•mol-1,将氯化钴溶液置于冰水浴中,溶液变成粉红色,则可知:a<0 | |
| D. | 用容量瓶配制一定物质的量浓度的溶液,定容时俯视刻度线,所配溶液浓度偏小 |
分析 A.某些吸热反应也可以自发进行,依据△H-T△S<0分析判断;
B.反应焓变大于0,熵变大于0,反应向熵变增大的方向进行;
C.降低温度,化学平衡向着放热方向进行;
D.用容量瓶配制一定物质的量浓度的溶液,定容时俯视刻度线,相当于加水量偏少.
解答 解:A.某些吸热反应也可以自发进行,依据△H-T△S<0分析,△H>0,△S>0,常温下可以△H-T△S<0,如氢氧化钡晶体和氯化铵反应,是吸热反应,常温下可以自发进行,故A错误;
B.反应焓变大于0,熵变大于0,反应向熵变增大的方向进行,NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ/mol,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向,故B正确;
C.氯化钴溶液中存在下列平衡:[[Co(H2O)6]2+(粉红色)+4Cl-?[CoCl4]2-(蓝色)+6H2O△H=akJ•mol-1,Co(H2O)6]2+溶液中显粉红色,将氯化钴溶液置于冰水浴中,降低温度,平衡逆向移动,所以反应是吸热的,所以焓变大于零,故a>0,故C错误;
D.用容量瓶配制一定物质的量浓度的溶液,定容时俯视刻度线,相当于加水量偏少,所配溶液浓度偏大,故D错误;
故选B.
点评 本题综合考查了反应自发性的判断、平衡移动原理、溶液的配置等,属于综合知识的考查,难度中等,注意把握反应自发性的判断方法:△H-T△S<0自发进行.


科目:高中化学 来源: 题型:解答题
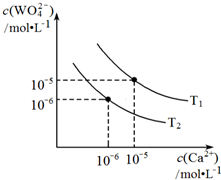 钨酸钙是非常重要的化学原料,主要用于生产钨铁、钨丝及钨合金等钨制品.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙.发生反应:
钨酸钙是非常重要的化学原料,主要用于生产钨铁、钨丝及钨合金等钨制品.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙.发生反应:| 温度/℃ | 25 | 50 | 90 | 100 |
| K1 | 79.96 | 208.06 | 222.88 | 258.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H1H2(g)+Cl2(g)=2HCl(g);△H2 | |
| C. | 2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2 | |
| D. | S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化物:CO2、NO、SO2、H2O | B. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | ||
| C. | 铵盐:NH4Cl、NH4NO3、NH3•H2O | D. | 碱性氧化物:Na2O、CaO、CO2、Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com