
| A. | 20Ne和22Ne互为同位素 | B. | 20Ne和22Ne互为同素异形体 | ||
| C. | 20Ne和22Ne的质量数相同 | D. | 20Ne和22Ne的中子数相同 |
分析 具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素.同种元素形成的不同单质为同素异形体.在原子中,核电荷数=质子数=核外电子数,质量数=质子数+中子数.
解答 解:A.由具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素,20Ne和22Ne互为同位素,故A正确;
B,同种元素形成的不同单质为同素异形体,20Ne和22Ne不是同素异形体,故B错误;
C、20Ne和22Ne的质量数分别为20、22,故C错误;
D、20Ne和22Ne的中子数分别为20-10=10、22-10=12,故D错误;
故选:A.
点评 本题主要考查了同位素,同素异形体,在判断时要抓住各自的研究对象分别为:原子、化合物.同时还考查了原子的定义和构成,题目难度不大.


科目:高中化学 来源: 题型:解答题
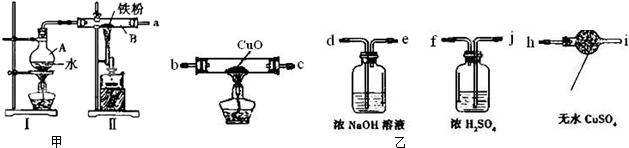
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | ||||
| E | B | C | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cs与U的质子数差值为37 | B. | Cs与U的中子数差值为98 | ||
| C. | 铯137的电子数是82 | D. | 铀元素的相对原子质量是235 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 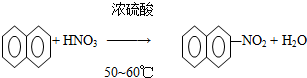 | |
| B. | 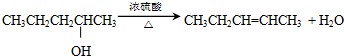 | |
| C. | CH3CHO+H2$→_{催化剂}^{高温高压}$CH3CH2OH | |
| D. | (CH3)2CHCH=CH2+HI→(CH3)2CHCHICH3+(CH3)2CHCH2CH2 I |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
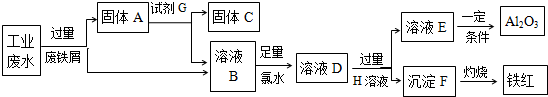
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
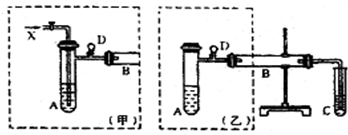

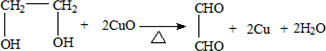 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com