
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| B | SO2通入酸性高锰酸钾溶液 | 高锰酸钾溶液褪色 | SO2具有还原性 |
| C | 溴乙烷与NaOH溶液共热后,加HNO3酸化的AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷发生了水解 |
| D | 向等浓度的KBr、KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgBr)>Ksp(AgI) |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、吸收29.2kJ热量 |
| B、放出29.2kJ热量 |
| C、放出7.3kJ热量 |
| D、吸收7.3kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
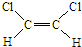 和
和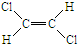 两种不同的空间异构体,称为顺反异构.下列能形成类似上述空间异构体的是( )
两种不同的空间异构体,称为顺反异构.下列能形成类似上述空间异构体的是( )| A、1-丁烯 | B、2-甲基-1-丙烯 |
| C、2-丁烯 | D、丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6mL | B、4.5mL |
| C、2mL | D、3mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、⑦④ | C、①③ | D、⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在某容积不变的密闭容器中,有可逆反应:mA(g)+nB(g)?pC(g)+qD(S)△H<0如图1某反应过程中各物质物质的量n(mol)随时间t的变化曲线图.
(1)在某容积不变的密闭容器中,有可逆反应:mA(g)+nB(g)?pC(g)+qD(S)△H<0如图1某反应过程中各物质物质的量n(mol)随时间t的变化曲线图.查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 高温高压 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com