
| A. | 氧化性:Cl2>Fe3+>I2 | B. | 氧化性:Fe3+>I2>Cl2 | ||
| C. | 还原性:I-<Fe2+<Cl- | D. | 还原性:Cl-<I-<Fe2+ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
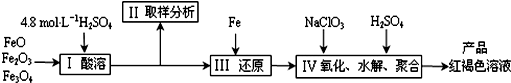
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40g NaOH固体溶解于1L水中 | |
| B. | 将22.4L氯化氢气体溶于水配成lL溶液 | |
| C. | 将1L 10mol/L的浓盐酸与9L水混合 | |
| D. | 20g NaOH固体溶解在水中配成500mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4、6、8、14 | B. | 4、6、8、15 | C. | 5、6、8、14 | D. | 4、5、6、8、14 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .E的周期表中的位置:第三周期第ⅥA族.
.E的周期表中的位置:第三周期第ⅥA族.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 更新采煤、采油技术,提高产量以满足工业生产快速发展的需要 | |
| B. | 控制含磷洗涤剂的使用,防止水体富营养化,保护水资源 | |
| C. | 开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 | |
| D. | 落实资源的“3R”发展观,即减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com