
| A�� | ����������̼ԭ�ӿ��ܴ���ͬһֱ���� | |
| B�� | ȫ������ĵ���ʽΪ��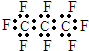 | |
| C�� | ��ͬѹǿ�£��е㣺C3F8��C3H8 | |
| D�� | һ��ȫ�������������10�����õ��Ӷ� |
���� A�����ݷ��ӵĿռ�ṹ�жϣ�
B�����ݹ��ۻ��������ʽ����д�����жϣ�
C���ṹ���Ƶ����ʣ���Է�������Խ���Ӽ��������ҲԽ�е�ߣ�
D��ȫ������ĵ���ʽΪ�� ������10�����õ��Ӷԣ�
������10�����õ��Ӷԣ�
��� �⣺A��ȫ��������Կ�����CF4�е�����Fԭ�ӱ�����CF3ȡ����CF4����������ṹ������CF4�е�������Fԭ�Ӻ�Cԭ�Ӷ�����ͬһֱ���ϣ�����ȫ���������������̼ԭ�Ӳ����ܴ���ͬһֱ���ϣ���A����
B��Fԭ�ӵŶԵ���û�������B����
C��C3F8��C3H8�ṹ���ƣ�����Է�������ǰ�ߴ��Ӽ��������Ҳ�е�ߣ���C����
D��ȫ������ĵ���ʽΪ�� ������10�����õ��Ӷԣ���D��ȷ��
������10�����õ��Ӷԣ���D��ȷ��
��ѡD��
���� ���⿼�����ʽ�����ӽṹ�����Ӽ������������Լ��ͷǼ��Լ����ѶȲ���ע��ṹ���Ƶ����ʣ���Է�������Խ���Ӽ��������ҲԽ�е�ߣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������CO2��SO2��SiO2��Na2O | B�� | ��Na2CO3��KHCO3��Cu2��OH��2CO3 | ||
| C�� | �ǵ���ʣ��ƾ������ǡ�NH3�������� | D�� | ����Һ�ȡ����ᡢ��������ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������Ȼ�����Һ��ϣ�AgNO3+Cl-�TAgCl��+NO3- | |
| B�� | ��NH4��2SO4��Һ�м�������Ba��OH��2��Ba2++SO42-�TBaSO4�� | |
| C�� | ����ͭ����ϡ���CuO+2H+�TCu2++H2O | |
| D�� | NaHCO3��Һ�еμ�ϡ���2H++CO32-�TH2O+CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��4NA������ת��ʱ���ų�890 kJ������ | |
| B�� | ��NA��C-H������ʱ���ų�890 kJ������ | |
| C�� | ��2NA��H2O��l������ʱ���ų�890 kJ������ | |
| D�� | ��NA��C��O��Ĺ��õ��Ӷ�����ʱ���ų�890 kJ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
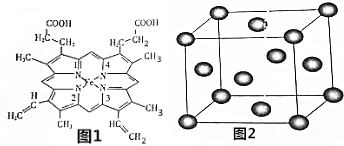
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C2H4��C2H2��CO2 | B�� | CH4��CHCl3��CO2 | C�� | Cl2��H2��N2 | D�� | NH3��H2O��CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
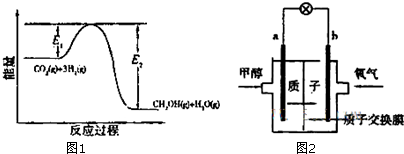
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3mol | B�� | 1.5mol | C�� | 1mol | D�� | 0.5mol |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com