
分析 (1)根据配制一定物质的量浓度的溶液步骤选用仪器;
(2)依据m=CVM计算需要溶质的质量;
(3)容量瓶为精密仪器,不能盛放过冷、过热液体;
(4)为保证实验成功,应将所有溶质全部转移到容量瓶中;
(5)依据定容的正确操作解答;
(6)分析操作对溶质的物质的量和溶液体积的影响,根据c=$\frac{n}{V}$分析产生的误差;
(7)如果加水定容时超出了刻度线,导致溶液体积偏大,依据c=$\frac{n}{V}$分析产生的误差,凡是错误操作导致实验失败且无法补救的必须重新配制;
解答 解:(1)配制500mL物质的量浓度为0.4mol/L氢氧化钠的步骤有:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,则使用的仪器有:托盘天平、药匙、烧杯、量筒、玻璃棒、500mL容量瓶、胶头滴管等,所以还需要的仪器:500mL容量瓶 胶头滴管;
故答案为:500mL容量瓶 胶头滴管;
(2)配制0.4mol•L-1NaOH溶液500mL,需要氢氧化钠的质量m=0.4mol/L×40g/mol×0.5L=8.0g;
故答案为:8.0;
(3)氢氧化钠溶解放出大量的热,而容量瓶为精密仪器,不能盛放过冷、过热液体,所以应冷却后再进行移液操作;
故答案为:冷却;
(4)为保证实验成功,应将所有溶质全部转移到容量瓶中,包括洗涤液;
故答案为:注入容量瓶中;
(5)向容量瓶中加入蒸馏水,到液面距刻度线1-2cm时,改用胶头滴管加蒸馏水至液面与刻度线相切;
故答案为:距刻度线1-2cm;
(6)A.所用的固体NaOH长时间放置在密封不好的容器中,则称取的溶质氢氧化钠质量偏小,溶质的物质的量偏小溶液浓度偏小,
故答案为:偏小;
B.容量瓶用蒸馏洗涤后残留有少量的水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度无影响;
故答案为:无影响;
C.定容时俯视溶液的液凹面,导致溶液体积偏小,溶液浓度偏大,
故答案为:偏大;
(7)如果加水定容时超出了刻度线,导致溶液体积偏大,依据c=$\frac{n}{V}$可知溶液浓度偏小,该操作导致实验失败且不能补救,必须重新配制;
故答案为:偏小;重新配制.
点评 本题考查了物质的量浓度的有关计算及配置一定物质的量浓度的溶液等知识点,明确配制原理及操作步骤是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
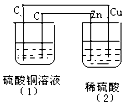 如图的装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上通过了0.02mole-.若不考虑溶液体积的变化,下列叙述正确的( )
如图的装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上通过了0.02mole-.若不考虑溶液体积的变化,下列叙述正确的( )| A. | 相同条件下,两容器产生的气体体积相同 | |
| B. | (1)、(2)溶液的pH值均减小 | |
| C. | (1)中阳极电极反应方程式为:4OH--4e-═2H2O+O2↑ | |
| D. | (2)中正极反应为Zn-2e-═Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 半反应式 | Fe2+表现的性质 | 完成该半反应式选用的物质 |
| A | Fe2++2e-═Fe | 氧化性 | I- |
| B | Fe2++2e-═Fe | 还原性 | Al |
| C | Fe2+-e-═Fe3+ | 氧化性 | Fe |
| D | Fe2+-e-═Fe3+ | 还原性 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
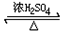 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 | B. | 0.7 | C. | 1.0 | D. | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸雨的形成CO2+H2O═H2CO3化合反应 | |
| B. | 干粉灭火器的反应原理6NaHCO3+2Al2(SO4)3═3Na2SO4+6CO2↑+Al(OH)3↓复分解反应 | |
| C. | 用稀硫酸洗去附着在试管壁上的铜Cu+H2SO4═CuSO4+H2↑ 置换反应 | |
| D. | 误服用氯化钡后用硫酸镁解毒BaCl2+MgSO4═MgCl2+BaSO4↓ 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个原子的氢气在标准状况下的体积约为22.4L | |
| B. | 25℃,1.01×105Pa,64gS02中含有的原子数为3NA | |
| C. | 40gNaOH溶解在1L水中,则其100 mL溶液中含Na+数为0.1NA | |
| D. | 标准状况下,11.2 LH20含有的分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com