
(12��) �״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��ӦI�� CO(g) �� 2H2(g)
 CH3OH(g)
��H1
CH3OH(g)
��H1
��ӦII�� CO2(g)
�� 3H2(g)
 CH3OH(g) + H2O(g)
��H2
CH3OH(g) + H2O(g)
��H2
��������Ӧ���ϡ�ԭ�Ӿ��á�ԭ����� ���I������
����֪��Ӧ��������仯��ͼ��ʾ�� �ɱ��������ж� ��H1 0 �����������������������
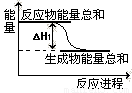
��ij�¶��£���2 mol CO��6 mol H2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)�� 0.2 mol��L�� ��CO��ת����Ϊ
��2����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H �� ��1275.6 kJ��mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H �� ��566.0 kJ��mol
�� H2O(g) �� H2O(l) ��H �� ��44.0 kJ��mol
�����1 mol�״�����ȫȼ������1 molһ����̼��Һ̬ˮ�ų�������Ϊ________
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ�����������ͼ��ʾ�ĵ��װ�á�
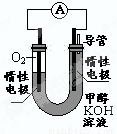
�ٸõ�������ĵ缫��ӦΪ____________
�ڹ���һ��ʱ������Һ��pH��С���õ���ܷ�Ӧ�Ļ�ѧ����ʽΪ____________.
��1����1 �ڣ� ��80% ��2��442.8KJ
��3����O2+2H2O+4e-=4OH- ��2CH3OH+3O2+4OH-=2CO32-+6H2O
����������1���ٸ��ݷ���ʽ��֪����ӦI�з�Ӧ��ȫ��ת��Ϊ�״������ϡ�ԭ�Ӿ��á�ԭ��
�ڸ���ͼ���֪����Ӧ�������������������������������Է�Ӧ�Ƿ��ȷ�Ӧ����H1��0��
�۷�ӦǰCO��Ũ����1mol/L���������ĵ�CO��1mol/L��0.2mol/L��0.8mol/L��������ת������80����
��2�����鷴Ӧ�ȵ��йؼ��㡣���ݸ�˹���ɿ�֪�����٣��ڣ��ۡ�4����2���õ�CH3OH(l) �� O2(g) �� CO2(g) �� 2H2O(l)�����Է�Ӧ���ǡ�H������1275.6 kJ��mol��566.0 kJ��mol��44.0 kJ��mol��4����2����442.8kJ��mol������1 mol�״�����ȫȼ������1 molһ����̼��Һ̬ˮ�ų�������Ϊ442.8kJ��
��3����ԭ����������õ����ӣ���������������ͨ�롣���ڵ����������������Һ������������Ӧʽ��O2+2H2O+4e-=4OH-��
�����ڸ����Ǽ״�ʧȥ���ӣ�����̼��غ�ˮ�������ܷ�Ӧʽ��2CH3OH+3O2+4OH-=2CO32-+6H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013������ʡ��Ϫһ�и����ڶ����¿���ѧ�Ծ����������� ���ͣ������
(12��) �״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��ӦI�� CO(g) �� 2H2(g)  CH3OH(g) ��H1
CH3OH(g) ��H1
��ӦII�� CO2(g) �� 3H2(g)  CH3OH(g) + H2O(g) ��H2
CH3OH(g) + H2O(g) ��H2
��������Ӧ���ϡ�ԭ�Ӿ��á�ԭ����� ���I������
����֪��Ӧ��������仯��ͼ��ʾ���ɱ��������ж� ��H1 0 �����������������������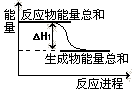
��ij�¶��£���2 mol CO��6 mol H2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)�� 0.2 mol��L�� ��CO��ת����Ϊ
��2����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H ����1275.6 kJ��mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H ����566.0 kJ��mol
�� H2O(g) �� H2O(l) ��H ����44.0 kJ��mol
�����1 mol�״�����ȫȼ������1 molһ����̼��Һ̬ˮ�ų�������Ϊ________
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ�����������ͼ��ʾ�ĵ��װ�á�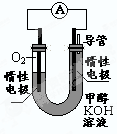
�ٸõ�������ĵ缫��ӦΪ____________
�ڹ���һ��ʱ������Һ��pH��С���õ���ܷ�Ӧ�Ļ�ѧ����ʽΪ____________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ��ӱ�ʡ�����и�����ѧ����ĩ���п��������ۺϻ�ѧ�Ծ��������棩 ���ͣ������
(12�֣��״���Ϊ������������ȼ�ϣ���ҵ�Ͽ���CO��H2�ϳɡ��÷�Ӧ���Ȼ�ѧ����ʽ��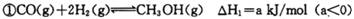
�÷�Ӧ��ԭ��CO��H2��������Ϊȼ�ϣ����ǵ��Ȼ�ѧ����ʽΪ��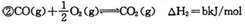
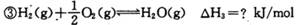
ijЩ��ѧ���ļ����������±�
��ش��������⣺
(1)��Ӧ���еĦ�H3=________kJ/mol
(2) CH3OHȼ������CO2(g)��H2O(g)���Ȼ�ѧ����ʽΪ
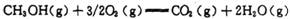 ,�÷�Ӧ���ʱ�
,�÷�Ӧ���ʱ�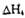 =________kJ/mol (�ú�a��b��ʽ�ӱ�ʾ)��
=________kJ/mol (�ú�a��b��ʽ�ӱ�ʾ)��
(3) �������¶ȣ���Ӧ�ٵĻ�ѧƽ�ⳣ��Kֵ��________ (���������С�����䡱)��
(4) �״�һ���������һ���{Ч������Ⱦ���ӽ�����ȼ�ϵ�أ�����ܷ�ӦΪ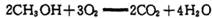 �������ڴ����������ṩ���Ӻ͵��ӡ���ͼΪ�õ�ص�ʾ��ͼ����缫d�Ϸ����ĵ缫��ӦʽΪ________________��
�������ڴ����������ṩ���Ӻ͵��ӡ���ͼΪ�õ�ص�ʾ��ͼ����缫d�Ϸ����ĵ缫��ӦʽΪ________________��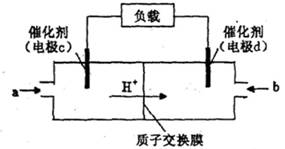
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���人�и����������в��Ի�ѧ�Ծ� ���ͣ������
��12 �֣���Դ����������������ٵ��ش���⡣�״���δ����Ҫ����ɫ��Դ֮һ��
��l����֪���� 25 �桢101 kPa ��,1g �״�ȼ������ CO2��Һ̬ˮʱ���� 22��70kJ ����д���״�ȼ�յ��Ȼ�ѧ����ʽ ��
��2����CO2��H2�ϳɼ״��Ļ�ѧ����ʽΪ��CO2��g��+ 3H2
��g��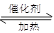 CH3OH��g��+H2O ��g ��.�������������������£�ʵ�����¶ȶԷ�Ӧ��Ӱ������ͼ��ʾ��ע��T1��T2������300 �棩
CH3OH��g��+H2O ��g ��.�������������������£�ʵ�����¶ȶԷ�Ӧ��Ӱ������ͼ��ʾ��ע��T1��T2������300 �棩
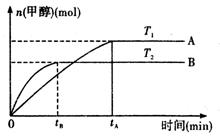
�ٺϳɼ״���Ӧ�ġ�H 0�����>������<����=�� ����
��ƽ�ⳣ���ı���ʽΪ: ���¶�ΪT2ʱ��ƽ�ⳣ�� �¶�ΪT1ʱ��ƽ�ⳣ�����>������<����=����
����T1�¶��£���1mol CO2�� 1 molH2����һ�ܱպ��������У���ַ�Ӧ�ﵽƽ�����CO2ת����Ϊ�����������ڵ�ѹǿ����ʼѹǿ�ı�ֵΪ ��
��3�����ü״�ȼ�ϵ���������ͼ��ʾ��װ�á�
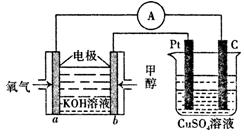
��װ���� Pt ��Ϊ ����д�� b���ĵ缫��Ӧʽ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com