
设NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A.含有NA个氧原子的氧气在标准状况下的体积约为22.4 L
B.2 L 0.3 mol·L-1的硫酸钾溶液中钾离子浓度为1.2 mol·L-1
C.常温常压下,32 g O2和O3的混合气体所含原子数为2NA
D.25℃,1.01×105Pa,64 g SO2中含有的原子数为3NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共 存的是( )
存的是( )
A.0.1 mol·L-1 NaOH溶液:K+、Na+、AlO2-、CO32-
B.0.1 mol·L-1 Na2CO3溶液:K+、Al3+、NO3-、Cl-
C.pH=3.5的溶液:K+、NH4+、I-、Fe3+
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。
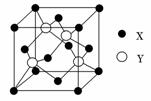
①在1个晶胞中,X离子的数目为________。
②该化合物的化学式为________。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是________。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是________。
(4)Y与Z可形成YZ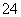 。
。
①YZ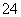 的空间构型为________(用文字描述)。
的空间构型为________(用文字描述)。
②写出一种与YZ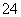 互为等电子体的分子的化学式:________。
互为等电子体的分子的化学式:________。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图为硬脂酸甘油酯在碱性条件下水解的装置图。进行皂化反应时的步骤如下:
(1)在圆底烧瓶中加入8 g硬脂酸甘油酯,然后加入2 g氢氧化钠、5 mL水和10 mL酒精,加入酒精的作用是_____________________________________。
(2)隔着石棉网给反应物加热约10分钟,皂化反应基本完成,所得的
混合物为________(填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。
(3)向所得混合物中加入________,静置一段时间后,溶液分为上下两层,肥皂在________层,这个操作称为________。
(4)图中长玻璃导管的作用为________。
(5)日常生活中用加热的纯碱溶液来洗涤粘有油脂的器皿的原因是__________________________________________________________________
________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
①钠、氢气都能在氯气中燃烧生成白色烟雾
②铜丝在氯气中燃烧,生成蓝绿色的氯化铜
③液氯就是氯气的水溶液,它能使干燥的有色布条褪色
④久置的氯水,因氯气几乎完全挥发掉,剩下的只有水
A.① B.①和② C.①和④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中要测定部分变质的过氧化钠的纯度,可用如图装置实现。
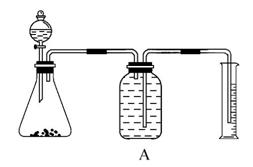
(1)锥形瓶中应放药品________,分液漏斗中放__________,锥形瓶中发生的化学方程式为_________________________________________。
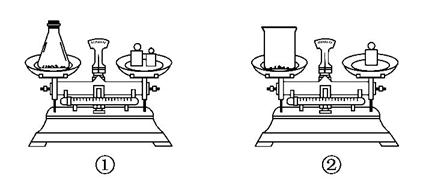
(2)如图用托盘天平称取样品,应选用如图中的__________(填“①”或“②”)。不选用另一装置的原因是___________________________________。
(3)若取用样品的质量为2.5 g,收集到气体的体积为280 mL(标准状况),则样品中Na2O2的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
同种物质中同一价态的元素部分被氧化,部分被还原的氧化还原反应是
( )
A.3Br2+6KOH====5KBr+KBrO3+3H2O
B.MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
C.2KNO3 2KNO2+O2↑
2KNO2+O2↑
D.NH4NO3 N2O↑+2H2O
N2O↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学通过系统实验探究铝及其化合物的性质,操作正确且能达到目的的是 ( )
A.用互相滴加的方法可鉴别氯化铝溶液、氢氧化钠溶液
B.向氯化铝溶液中滴加过量氨水,最终得到澄清溶液
C.常温下铝与浓硝酸反应制得大量的NO2
D.AlCl3溶液加热蒸干得到无水氯化铝晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
铝及其化合物用途广泛。工业上焙烧明矾【KAl(SO4)2·12H2O】可得到A12O3,反应的化学方程式为4KAl(SO4)2·12H2O+3S 2K2SO4+2A12O3+9SO2↑+48H2O。
2K2SO4+2A12O3+9SO2↑+48H2O。
请回答下列问题:
(1)在焙烧明矾的反应中,被氧化和被还原的元素质量之比是________________。
(2)焙烧明矾时产生的SO2可用来制硫酸。已知25℃、10lkPa时:

(3)工业上利用电解熔融的A12O3制备Al,其化学方程式是_____________________;电解时阳极和阴极材料均为石墨,电解时所消耗的电极是__________(填“阳极”或“阴极”)。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液,可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式为____________________;
②电池总反应的化学方程式为_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com