
分析 已知 ①C(s)+O2(g)═CO2(g)△H=-390 kJ•mol-1
②CO2(g)+C(s)═2CO(g)△H=+170 kJ•mol-1
目标反应为:2CO(g)+O2(g)═2CO2(g)△H
根据盖斯定律,将反应①②做相应的加减得目标反应,然后将反应热△H做相应的变化即可得目标反应的△H.
解答 解:已知 ①C(s)+O2(g)═CO2(g)△H=-390 kJ•mol-1
②CO2(g)+C(s)═2CO(g)△H=+170 kJ•mol-1
将①-②可得:2CO(g)+O2(g)═2CO2(g)△H=(-390KJ/mol)-170KJ/mol=-560KJ/mol,
即CO的燃烧的热化学方程式为:2CO(g)+O2(g)═2CO2(g)△H=-560KJ/mol,
故答案为:2CO(g)+O2(g)═2CO2(g)△H=-560KJ/mol.
点评 本题考查盖斯定律的应用以及化学方程式的有关计算,正确应用盖斯定律是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
 常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )
常温下,取pH=2的 HA溶液与HB溶液各1mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示.下列叙述正确的是( )| A. | 稀释前,c(HB)>c(HA)=0.01 mol•L-1 | |
| B. | HB的电离方程式为HB=H++B- | |
| C. | NaA的水溶液中,离子浓度大小为:c(Na+)>c(A-)>c(OH-)>c(H+) | |
| D. | NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半 径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | G元素的单质不存在同素异形体 | |
| B. | I在DB2中燃烧生成两种化合物 | |
| C. | A的单质能将E单质从HE3的溶液中置换出来 | |
| D. | A、H、J的离子半径由大到小顺序是A>J>H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
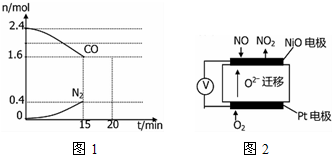
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 升高温度,同时增大压强 | |
| B. | 降低温度.同时减小压强 | |
| C. | 增大反应物的浓度,同时使用适宜的催化剂 | |
| D. | 增大反应物的浓度,同时减小生成物的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A. | X、Y、Z的阴离子电子层结构均与R原子的相同 | |
| B. | 常压下,Y单质的沸点比Z单质的沸点高 | |
| C. | W的氢化物的稳定性比X的氢化物的稳定性强 | |
| D. | 最高价氧化物的水化物酸性W比Y强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com