
| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.3NA | |
| B. | 4.48L氨气分子中含有0.6NA个N-H键 | |
| C. | 铁、Cu片、稀硫酸组成原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA | |
| D. | 4℃时,18g2H216O中含有共用电子对数为2NA |
分析 A.过氧化钠的化学式中含有2个钠离子、1个过氧根离子;
B.没有指出在标准状况下,不能使用标准状况下的气体摩尔体积计算;
C.该原电池中,铁失去电子生成亚铁离子;
D.18g 2H216O的物质的量为0.9mol,然后根据 2H216O中含2对共用电子对来分析.
解答 解:A.7.8g过氧化钠的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,0.1mol过氧化钠中含有0.2mol钠离子、0.1mol过氧根离子,总共含有0.3mol离子,故A正确;
B.不是标准状况下,不能使用标准状况下的气体摩尔体积计算氨气的物质的量,故B错误;
C.5.6g铁的物质的量为0.1mol,0.1mol铁失去0.2mol电子生成0.1mol亚铁离子,则流过外电路的电子为0.2NA,故C错误;
D.18g 2H216O的物质的量为0.9mol,而 2H216O中含2对共用电子对,故0.9mol中含1.8NA对共用电子对,故D错误;
故选
点评 本题考查阿物质的量的计算,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| 选项 | 实 验 操 作 | 实验目的或结论 |
| A | 向某溶液中加入几滴氯水后再滴入KSCN溶液,溶液变红 | 该溶液中一定含Fe2+ |
| B | 将吸有NaOH溶液的长胶头滴管伸入盛有FeSO4溶液的试管底部并缓慢挤出碱液 | 防止加碱过程中带入空气,制备并较长时间观察到白色絮状的Fe(OH)2沉淀 |
| C | 蒸馏实验操作时将温度计插入液面以下但不能触碰到烧瓶内壁 | 准确测定馏分的温度,以便于液体混合物分离 |
| D | Fe(OH)3胶体的电泳实验中发现阴极附近颜色加深而阳极附近颜色变浅 | 说明Fe(OH)3胶体带正电荷 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 HSO3-+OH-,所以滴入酚酞后溶液变红,在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.
HSO3-+OH-,所以滴入酚酞后溶液变红,在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.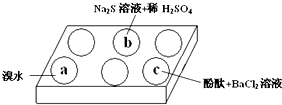
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融的Al2O3可以制得金属铝和氧气,该反应是一个放出能量的反应 | |
| B. | 水分解产生氢气和氧气时放出能量 | |
| C. | 相同状况下,反应2CO+O2═2CO2是一个放热反应,则反应2CO2═2CO+O2是一个吸热反应 | |
| D. | 氯化氢分解成氢气和氯气时需要吸收能量,实验氯化氢的总能量高于氢气和氯气的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| Ⅰ | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| Ⅲ | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
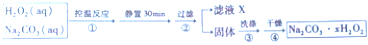
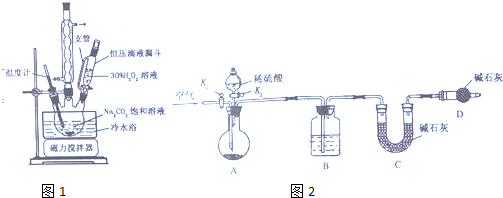
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
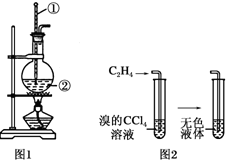 如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:
如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com