


科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
为确定两种氮肥的组成,进行下列实验:(1)取少量样品与消石灰共热,放出可使湿润的红色石蕊试纸变蓝的气体,此气体为___________,证明化肥中含有__________离子.
(2)将上述反应后的固体投入盐酸中,生成无色无味气体,通入澄清石灰水后出现浑浊,此气体是________,证明化肥中含有________离子或________离子.
(3)另取少量试样溶于水中,加入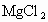 溶液后无明显变化,可知化肥中一定含有__________离子,而排除了__________离子.
溶液后无明显变化,可知化肥中一定含有__________离子,而排除了__________离子.
(4)向试样的水溶液中,加用盐酸酸化的 溶液,立即产生白色沉淀,可知化肥中含有________离子.
溶液,立即产生白色沉淀,可知化肥中含有________离子.
由以上可知,两种化肥分别是_____________和__________(写化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:022
为确定两种氮肥的组成,进行下列实验:(1)取少量样品与消石灰共热,放出可使湿润的红色石蕊试纸变蓝的气体,此气体为___________,证明化肥中含有__________离子.
(2)将上述反应后的固体投入盐酸中,生成无色无味气体,通入澄清石灰水后出现浑浊,此气体是________,证明化肥中含有________离子或________离子.
(3)另取少量试样溶于水中,加入 溶液后无明显变化,可知化肥中一定含有__________离子,而排除了__________离子.
溶液后无明显变化,可知化肥中一定含有__________离子,而排除了__________离子.
(4)向试样的水溶液中,加用盐酸酸化的 溶液,立即产生白色沉淀,可知化肥中含有________离子.
溶液,立即产生白色沉淀,可知化肥中含有________离子.
由以上可知,两种化肥分别是_____________和__________(写化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有________________(任写一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有________________(填写序号)。
A.矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.转化器中使用适宜的温度
D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行
F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为___________。
(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体间进行了“对流”。请简单描述吸收塔中反应物之间是怎样对流的。
_____________________________________________________________。
②工业生产中常用氨—酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)
_____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com