
����Ŀ����֪�����������ݣ�7.2��10��4��4.6��10��4��4.9��10��10�ֱ��������йص�������ĵ��볣��������֪���з�Ӧ���Է�����
NaCN��HNO2===HCN��NaNO2
NaCN��HF===HCN��NaF
NaNO2��HF===HNO2��NaF
�ɴ˿��ж�������������ȷ���� (����)
A. K(HF)��7.2��10��4 B. K(HNO2)��4.6��10��4
C. ������������������Ӧ���ɵó����� D. K(HCN)<K(HNO2)<K(HF)
���𰸡�C
������������ǿ��������ĸ��ֽⷴӦԭ�����ɷ�ӦNaCN��HNO2=HCN��NaNO2�ó�����HNO2![]() HCN���ɷ�ӦNaCN��HF=HCN��NaF�ó�����HF
HCN���ɷ�ӦNaCN��HF=HCN��NaF�ó�����HF![]() HCN���ɷ�ӦNaNO2��HF=HNO2��NaF�ó�����HF
HCN���ɷ�ӦNaNO2��HF=HNO2��NaF�ó�����HF![]() HNO2��������HF
HNO2��������HF![]() HNO2
HNO2![]() HCN������Խǿ����ƽ�ⳣ��Խ����K(HCN)<K(HNO2)<K(HF)��K��HF��=7.2
HCN������Խǿ����ƽ�ⳣ��Խ����K(HCN)<K(HNO2)<K(HF)��K��HF��=7.2![]() 10-4��K��HNO2��=4.6
10-4��K��HNO2��=4.6![]() 10-4��K��HCN��=4.9
10-4��K��HCN��=4.9![]() 10-10��A��B��D�����ȷ�����ݵ�1���͵�3����Ӧ���Եó����ۣ����ɵ�1���͵�2�����2���͵�3����Ӧ���ܵó����ۣ�C�����ѡC��
10-10��A��B��D�����ȷ�����ݵ�1���͵�3����Ӧ���Եó����ۣ����ɵ�1���͵�2�����2���͵�3����Ӧ���ܵó����ۣ�C�����ѡC��


 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д� �Ͻ�ƽ���Ȿϵ�д�
�Ͻ�ƽ���Ȿϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ�����X(g)��Y(g)���ܱ������н��п��淴Ӧ��X(g)��Y(g) ![]() 2Z(g)��W(s)����H��0������������ȷ���ǡ�������������
2Z(g)��W(s)����H��0������������ȷ���ǡ�������������
A. ƽ�ⳣ��KֵԽ��X��ת����Խ��
B. �ﵽƽ��ʱ����Ӧ����v��(X)��2v��(Z)
C. �ﵽƽ����¶ȣ�����Ӧ���ʼ�С�ı�����������Ӧ���ʼ�С�ı���
D. �ﵽƽ��������¶Ȼ�����ѹǿ�������ڸ÷�Ӧƽ�����淴Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ͻ���������¹ڲ�����Խ��Խ�������ʶ��ѧϰ��ѧ����Ҫ�ԡ�����˵����ȷ����
A.ҽ�þƾ�����¹ڷ��ײ�����������������
B.N95������ʹ�õľ۱�ϩ�������ںϳ���ά
C.Ϊ��ǿ��84������Һ������Ч�����ɼ���ϡ����
D.�ҹ����Ƶ������¹�����������ر���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ����Ҫ��ˮ��Դ�����з��������ڵ�����ˮ����
A.����B.���˷�C.��Һ��D.��ȡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��100��ʱ����0.1 mol N2O4����1L�ܱյ���ƿ�У�Ȼ����ƿ����100�� �ĺ��²��У���ƿ�ڵ�������Ϊ����ɫ��N2O4(g)![]() 2NO2 (g)��
2NO2 (g)��
���н�������˵��������Ӧ�ڸ��������Ѿ��ﵽƽ��״̬���� �� ��
��N2O4������������NO2����������֮��Ϊ1:2 ��NO2����������NO2����������� ����ƿ�������ѹǿ���ٱ仯 ����ƿ��������������ٱ仯 ��NO2�����ʵ���Ũ�Ȳ��ٸı� ����ƿ���������ɫ���ټ��� ����ƿ�������ƽ����Է����������ٱ仯 ����ƿ��������ܶȲ��ٱ仯��
A. �ڢۢݢޢ� B. �٢ܢ� C. �ܢޢ� D. ֻ�Тڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CaCl2��һ��������ˮ�����ʣ����ù��˵ķ�ʽ�����NaCl���룬�����������ۣ�ijС��ͬѧ�ڴ˻����ϼ����������ͼʵ�飺 
�ش��������⣺
��1����С��ͬѧ��ʵ��Ŀ������
��2����ͼ�����ڵIJ�������Ϊ������
��3������ʵ�鷽���õ���NaCl�����п϶��������ѧʽ�����ʣ�Ϊ�˽����������������˵õ�����Һ�м����������������ƣ���
��4����ijNa+Ũ��Ϊ0.3molL��1��ij��ɫ������Һ�У������ܺ������������ӣ�������K+��Ag+��Ca2+��Cu2+�� ������CO32����SO42����Cl����NO3��
��ȡ����Һ100mL���ȼ�������ϡ���ᣬ�ų���״����0.224L���壻�ټ�������ϡBa ��NO3��2��Һ���а�ɫ���������������Һ����ϴ�Ӹ���ù���2.33g����Һ�еμ���������Һ������������ش��������⣮
�ٲ���ȷ���Ƿ���ڵ��������� ��
���ж�K+�Ƿ���ڵĸ����������ڣ�c��K+������СŨ��Ϊmol/L��
�ۻ��Һ���˺�ϴ�ӳ������������ϴ���ķ����ǣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ�Ļ��������п��ܺ���NO��CO2��NO2��NH3��N2�еļ��֣���100mL�������ͼʵ�鴦��������õ�������Һ��������������ʣ�࣬���������ɿ���Ϊ�� �� 
A.NH3��NO2��N2
B.NH3��NO��CO2
C.NH3��NO2��CO2
D.NO��CO2��N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵���������( )
A. �������������ά B. ����������Ϳ�Ϻͺ�ɫ����
C. ���ȷ�Ӧ�����ں������� D. ��Һ̬���ƼغϽ������ԭ�ӷ�Ӧ�ѵ��Ƚ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��KClO3������һ�ֳ�����������������������ͼ��ʾ��
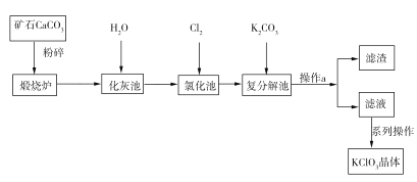
��ش��������⣺
��1��CaCO3����ǰҪ�����Ŀ����____________________________��
��2��д�����Ȼ��ء�������Ca(ClO3)2�Ļ�ѧ����ʽ��___________________________���÷�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ________��
��3������a������IJ���������©�����ձ���__________��
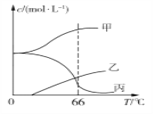
��4��ʵ������ȡKClO3��ͨ����Ӧ��3Cl2+6KOH![]() 5KCl+KClO3+3H2O�����ܱ���������9 ���KOH��Һ��ͨ������Cl2����ʱCl2������������Ҫ��________________������ͨ������Cl2������Һ���ȣ���Һ����Ҫ���ӵ�Ũ�����¶ȵı仯��ͼ��ʾ��ͼ�мס��ҡ������α�ʾ��������_________����������Cl2�Ļӷ���
5KCl+KClO3+3H2O�����ܱ���������9 ���KOH��Һ��ͨ������Cl2����ʱCl2������������Ҫ��________________������ͨ������Cl2������Һ���ȣ���Һ����Ҫ���ӵ�Ũ�����¶ȵı仯��ͼ��ʾ��ͼ�мס��ҡ������α�ʾ��������_________����������Cl2�Ļӷ���
��5����ͬѧΪ�ⶨ��ȡ��KClO3��Ʒ��ClO3�ĺ�������ȡ��Ʒa g��ȷ���Ƴ�1000 mL��Һ����������Һ��ȡ��10.00 mL����ƿ�У�ȷ����30.00 mL 1.00 mol��L1 (NH4)2Fe(SO4)2��Һ����������������ƿ�м���100 mL����ˮ��ij��������ԭ��Ӧָʾ������0.200 mol��L1 K2Cr2O7����Һ�ζ����յ㣬����5.00 mL����Ʒ��ClO3����������Ϊ______________������֪��Cr2O72-+6Fe2++14H+![]() 2Cr3++6Fe3++7H2O��ClO3�ɱ�Fe2+��ԭΪCl����
2Cr3++6Fe3++7H2O��ClO3�ɱ�Fe2+��ԭΪCl����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com