
【题目】CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( ) 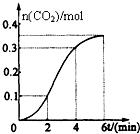
A.反应开始2分钟内平均反应速率最大
B.反应4分钟后平均反应速率最小
C.反应开始4分钟内温度对反应速率的影响比浓度大
D.反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小
科目:高中化学 来源: 题型:
【题目】关于吸热反应和放热反应,下列说法中错误的是
A. 反应物的总能量高于生成物的总能量时,发生放热反应
B. 需要加热才能进行的化学反应一定是吸热反应
C. 化学反应中的能量变化,除了热量变化外,还可以转化为光能、电能等
D. 化学反应过程中的能量变化,服从能量守恒定律
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式,且b>a。
Hg(I)+![]() O2(g)===HgO(s) △H=-akJ·mol-1
O2(g)===HgO(s) △H=-akJ·mol-1
Zn(s)+![]() O2(g)===ZnO(s) △H=-bkJ·mol-1
O2(g)===ZnO(s) △H=-bkJ·mol-1
由此可知反应Zn(s)+HgO(s) ![]() ZnO(s)+Hg(l)的焓变为
ZnO(s)+Hg(l)的焓变为
A. -(b-a) kJ·mol-1 B. +(b-a) kJ·mol-1
C. (b-a) kJ·mol-1 D. (b+a)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子可以大量共存的是
A. K+ SO42- Na+ HCO3- B. K+ Ag+ Cl- NO3-
C. Ba2+ Na+ OH- CO32- D. Al3+ NH4+ NO3- OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g)xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol/L.
(1)从开始反应至达到平衡状态,生成C的平均反应速率为 .
(2)x= .
(3)A的转化率与B的转化率之比为
(4)下列各项可作为该反应达到平衡状态的标志是(填字母).
A.压强不再变化
B.气体密度不再变化
C.气体平均相对分子质量不再变化
D.A的消耗速率与B的消耗速率之比为2:1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮及其化合物在生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) ![]() 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
CH4(g) + 4NO(g) ![]() 2N2(g)+CO2(g) + 2H2O(g) ΔH2。
2N2(g)+CO2(g) + 2H2O(g) ΔH2。
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1 734 kJ,则ΔH2=____。
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为Fe2O3(s) + 3CH4(g)![]() 2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
①若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____(填字母)。
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2#)的比值不变
d.固体的总质量不变
②该反应达到平衡时某物理量随温度的变化如图所示,当温度由T1升高到T2时,平衡常数KA___KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些___________。

a.H2的逆反应速率
b.CH4的体积分数
c.混合气体的平均相对分子质量
(3)若向20 mL 0.01 mol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是____(填字母)。

a.该烧碱溶液的浓度为0.02 mol·L-1
b.该烧碱溶液的浓度为0.01 mol·L-1
c.HNO2的电离平衡常数:b点>a点
d.从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实可以用勒夏特列原理解释的是( )
A. 新制的氯水在光照条件下颜色变浅
B. 使用催化剂,提高合成氨的产量
C. 高锰酸钾(KMnO4)溶液加水稀释后颜色变浅
D. H2、I2、HI平衡混合气体加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列开发利用自然资源制取化学品,其简示途径较为合理的是( )
A.海水 ![]()
![]() Br2
Br2
B.海产品(如海带等) ![]()
![]() 滤液
滤液 ![]()
![]()
![]() I2
I2
C.海水 ![]() Mg(OH)2
Mg(OH)2 ![]() MgO
MgO ![]() Mg
Mg
D.铝土矿 ![]() 滤液
滤液 ![]() Al(OH)3
Al(OH)3 ![]()
![]() Al
Al
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com