
分析 KMnO4与H2C2O4发生氧化还原反应,生成锰离子、水和二氧化碳,反应后,溶液由紫红色变为无色,故可通过测定溶液褪色所需时间来测定该反应的速率;
Na2S2O3和H2SO4发生氧化还原反应,生成单质硫,反应后,有淡黄色沉淀生成,故可通过出现浑浊的时间来测定该反应的速率.
解答 解:在KMnO4与H2C2O4反应中,反应后,溶液的紫红色颜色会消失,故可通过测定溶液褪色所需时间来测定该反应的速率;
在Na2S2O3和H2SO4反应中,反应后,有淡黄色沉淀生成,故可通过出现浑浊的时间来测定该反应的速率;
KMnO4与H2C2O4发生氧化还原反应,生成锰离子、水和二氧化碳,离子方程式为:2MnO4-+5H2C2O4 +6H+=2Mn2++8H2O+10CO2↑,
故答案为:溶液褪色所需时间;出现浑浊的时间;2MnO4-+5H2C2O4 +6H+=2Mn2++8H2O+10CO2↑.
点评 本题考查氧化还原反应及速率测定,为高频考点,把握反应中元素的化合价变化及速率测定方法为解答的关键,注意反应中的现象,侧重分析与应用能力的考查,题目难度不大.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:选择题
下列实验操作完全正确的是 ( )
编号 | 实验 | 操作 |
A | 用浓硫酸配制一定浓度的稀硫酸 | 准确量取浓硫酸,将浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中。 |
B | 除去BaSO4中的少量BaCO3 | 加入足量盐酸,充分反应后,过滤、洗涤、干燥 |
C | 量取盐酸溶液 | 用25 mL量筒量取4.0 mol/L的盐酸5.62 mL |
D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应生成氢氧化钠,则过氧化钠是碱性氧化物 | |
| B. | 钾、钠等碱金属着火时,立即用水或泡沫灭火器来灭火 | |
| C. | 用焰色反应可以检验钠的化合物跟钾的化合物 | |
| D. | 钠是一种还原性很强的金属,能把铜从硫酸铜溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡状态时A、B、C、D的反应速率均为0 | |
| B. | C的平均反应速率为:0.15mol/(L•min) | |
| C. | 充入N2使压强增大可加快反应速率 | |
| D. | 此时,V(A):V(B):V(C):V(D)=4:3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温恒容,充入N02气体,其转化率增大 | |
| B. | 加压,平衡向逆反应方向移动,混合气体颜色变深 | |
| C. | 若平衡常数增大,则可能是升高了温度或减小了体系的压强 | |
| D. | 当2v正(NO)=v逆(O2)时,反应达到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 肯定不含I- | B. | 肯定不含NH4+ | C. | 肯定不含Cu2+ | D. | 肯定不含SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
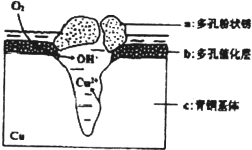 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义.
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
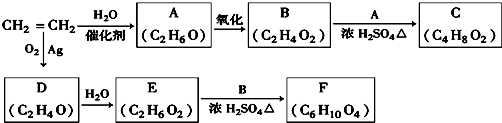
 CH3COOC2H5+H2O,该反应的类型为酯化反应(或取代反应);
CH3COOC2H5+H2O,该反应的类型为酯化反应(或取代反应); ;D的一种同分异构体的结构简式为CH3CHO.
;D的一种同分异构体的结构简式为CH3CHO.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com