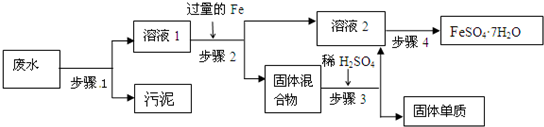
Ⅰ. 已知某工业废水中含有大量的CuSO
4,少量的Ag
+、Hg
2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其他物质.

(1)步骤1需用到的玻璃仪器除烧杯外有
漏斗、玻璃棒
漏斗、玻璃棒
.
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式)
Cu
Cu
,固体残渣的成分是(填化学式)
Ag、Cu
Ag、Cu
.
(3)步骤3中涉及的操作是:蒸发浓缩、
冷却结晶
冷却结晶
、过滤、烘干.
(4)步骤2应该在通风橱中进行,原因是
因为Hg有挥发性,且有毒
因为Hg有挥发性,且有毒
.
Ⅱ.((2)为1分,其余每空2分)某溶液中含有Na
+、SO
42-、SO
32-、CO
32-、Cl
-、Br
-中的若干种,依次进行下列实验,观察到的现象记录如下:①加入盐酸,有无色气体生成;②向原溶液中滴加氯水,无气体产生,再加CCl
4振荡,静置,CCl
4层呈橙色,用分液漏斗分液;③向分液后所得的水溶液中加入Ba(NO
3)
2和HNO
3的混合溶液,有白色沉淀生成,过滤;④在滤液中加AgNO
3和HNO
3的混合液,有白色沉淀产生.试回答:(提示:氯气会氧化SO
32-为SO
42-)
(1)原溶液中肯定存在的离子是
Na+、SO32-、Br-
Na+、SO32-、Br-
,肯定没有的离子是
CO32-
CO32-
;
(2)若步骤③改用BaCl
2和盐酸的混合溶液,对判断(1)结论有无影响
无影响
无影响
;
(3)步骤②中发生反应的离子方程式为
Cl2+2Br-═Br2+2Cl-
Cl2+2Br-═Br2+2Cl-
、
Cl2+SO32-+H2O═2Cl-+SO42-+2H+
Cl2+SO32-+H2O═2Cl-+SO42-+2H+
.




 阅读快车系列答案
阅读快车系列答案