

分析 (1)实验室用固体氯化铵和固体氢氧化钙加热反应制备氨气;气体制备一般顺序为:发生装置,净化装置,收集装置,尾气处理装置,结合氨气为碱性气体,密度小于空气密度,极易溶于水的性质解答;
(2)根据氢氧化钠溶于水放热,温度升高以及氢氧化钠增加了溶液中的氢氧根离子的浓度,使氨水中的平衡左移分析;
(3)据GH容器压强及GH混合后压强相等,氨气和氯化氢反应生成氯化铵分析解答;氨气、氯化氢为气体,反应生成的氯化铵是固体,压强减小,氯化铵为强酸弱碱盐,溶液显酸性,据此解答;
(4)探究某一因素对一定物质的量浓度NH4Cl水解程度的影响,则首先需要配置一定物质的量浓度NH4Cl溶液,据此分析缺少一样必要的玻璃仪器;
(5)根据影响NH4Cl水解的因素以及题干提供的限选试剂与仪器分析.
解答 解:(1)实验室中由固体物质制取氨气为固体氯化铵和固体氢氧化钙反应,反应的方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;实验室用加热固体氯化铵和氢氧化钙的方法制备氨气,制备的气体中含有水蒸气,氨气为碱性气体,应选择盛有碱石灰干燥管干燥气体,氨气极易溶于水,密度小于空气密度所以应选择向下排空气法收集气体,氨气极易溶于水,尾气可以用水吸收,注意防止倒吸的发生,所以正确的连接顺序为:a→c→d→h→g→i;
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;c→d→h→g→i;
(2)已知一定温度下,已知氨水中存在:NH3+H2O?NH3•H2O?NH4++OH-,将浓氨水与氢氧化钠固体混合,氢氧化钠溶于水(或氨水)的过程是放热的,促使NH3•H2O分解放出氨气,又氢氧化钠增加了溶液中的氢氧根离子的浓度,使氨水中的平衡左移,有利于氨气逸出,故答案为:氨水中存在:NH3+H2O?NH3•H2O?NH4++OH-,氢氧化钠溶于水(或氨水)的过程是放热的,促使NH3•H2O分解放出氨气,又氨气与氢氧化钠混合后,氢氧化钠增加了溶液中的氢氧根离子的浓度,使氨水中的平衡左移,有利于氨气逸出;
(3)G容器压强为150kPa,H容器为100kPa,所以打开旋塞1,氯化氢气体进入H瓶,与氨气反应生成氯化铵小颗粒,所以H瓶中现象是产生白烟;
氨气、氯化氢为气体,反应生成的氯化铵是固体,压强减小,所以再打开旋塞2,石蕊试液被吸入H瓶,氯化铵为强酸弱碱盐,溶液显酸性,则H瓶中的现象是紫色石蕊试液变红;
故答案为:产生白烟;G瓶压强比H瓶大,氯化氢进入H瓶与氨气反应生成氯化铵固体小颗粒形成白烟;烧瓶中的液体倒吸入H瓶,且紫色石蕊试液变红.
(4)探究某一因素对一定物质的量浓度NH4Cl水解程度的影响,则首先需要配置一定物质的量浓度NH4Cl溶液,则缺少一样必要的玻璃仪器,即配溶液用的容量瓶,故答案为:容量瓶;
(5)盐类水解,水解离子浓度越大,水解程度越小,盐类水解为吸热反应,温度越高,水解程度越大,根据题干提供的限选试剂与仪器中的温度计、恒温水浴槽(可调控温度),可选择温度不同对盐类水解的影响,故答案为:温度.
点评 本题主要考查了氨的制备、氨气以及铵盐的性质,掌握实验室制取氨气的原理以及铵盐的水解规律是解答的关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3CH═CHCH2CH3 | B. | CH2═CHCH═CH2 | C. | CH2═CHCH3 | D. | CH3-CH═CH-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若3molC12反应,得到氧化产物6mol | |
| B. | 若常温下生成22.4LN2,转移电子数6NA | |
| C. | 若转移6mol电子,被氧化的NH3是8mol | |
| D. | 若生成1 molNH4Cl转移电子n个,则NA=n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用铁触媒,加快合成氨反应速率 | |
| B. | 乙酸乙酯在碱性条件下水解比在酸性条件下水解更有利 | |
| C. | 打开汽水瓶盖,即有大量气泡逸出 | |
| D. | 配置FeCl3溶液时,加入少量盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g铁粉与50mL 4mol/L盐酸反应转移电子的数目为0.15NA | |
| B. | 常温下1 L pH=13的氢氧化钠溶液中由水电离出的H+的数目为0.1NA | |
| C. | 标准状况下,8.96L氢气、一氧化碳的混合气体完全燃烧,消耗氧分子的数目为0.2NA | |
| D. | 1mol苯中所含碳碳双键的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
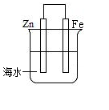
| A. | 此装置属于原电池 | |
| B. | 此装置中电子从铁经导线流向锌 | |
| C. | 此装置中的铁极上发生还原反应 | |
| D. | 该电化学防护法称为“牺牲阳极阴极保护法” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏可得到煤油、石蜡和沥青 | |
| B. | 自来水厂可用明矾对水进行消毒杀菌 | |
| C. | 氧化铝可用来制造耐高温的容器 | |
| D. | 装有硅胶的透气袋可防止富含油脂的月饼被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com