


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
| A、标准状况下,5LCH4与5LNH3的原子个数之比为5:4 |
| B、常温常压下,11.2LO3中所含氧原子个数大于1.5NA |
| C、同温、同压下,相同体积的N2和CO气体具有相同的分子数和相同的质量 |
| D、同温、同压下,CO和CO2的密度比为7:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,11.2L氖气中含有NA个氖原子 |
| B、2 mol?L-1 的Na2SO4溶液中含有4NA个Na+ |
| C、NA个水分子的相对分子质量之和等于水的摩尔质量 |
| D、常温常压下,9克水所含的电子数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
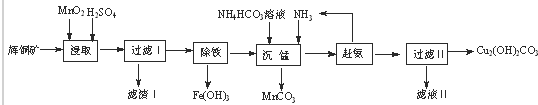
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaA溶液中c(Na+)-c(A-)=10-6mol?L-1 |
| B、NaB溶液中c(H+)+c(HB)=10-2mol?L-1 |
| C、将两溶液混合,混合溶液中:c(OH-)>5×10-3mol?L-1 |
| D、两溶液中的离子总数不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28g |
| B、常温下,1L0.1mol.L-1的NH4NO3溶液中NH4+和NO3-总数为0.2NA |
| C、标准状况下,4.48 L重水(D20)含有的中子数为2NA |
| D、1 mol甲基(-CH3)所含电子数为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 滴定法是一种用于测定的非常重要的方法.
滴定法是一种用于测定的非常重要的方法.查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
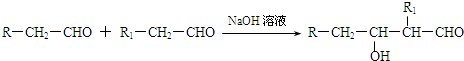
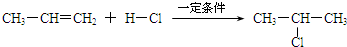

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、实验①可用于制取氨气 |
| B、实验②中最后一滴NaOH标准液使溶液由无色变为红色,即达到滴定终点 |
| C、装置③可用于吸收尾气中少量NH3或HCl,并防止倒吸 |
| D、装置④可用于从酒精水溶液中制取无水乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com