
分析 (1)由CO32-、SO42-与Ba2+分别产生Ba2CO3、BaSO4的白色沉淀,而BaCO3可溶于强酸产生气体CO2,BaSO4则不能.据此我们即可将四种溶液检验出来,由②③④反应可知,A、C、D都能与B反应产生沉淀,所以B为BaCl2溶液;而由⑤可知沉淀X为BaCO3,溶液Y呈酸性,由此产生沉淀X的③中A为Na2CO3,产生溶液Y的④中D为NaHSO4,因此C为Na2SO4,根据物质的性质判断所发生的反应,并书写相关离子方程式;
(2)①在氧化还原反应中氧化剂得到电子,还原剂失电子,氧化剂和还原剂之间得失电子数目相等;
②铜溶解于稀硝酸生成硝酸铜和NO;
③将Fe2+转化为Fe3+,需要加入氧化剂;
解答 解:(1)由②③④反应可知,A、C、D都能与B反应产生沉淀,所以B为BaCl2溶液;而由⑤可知沉淀X为BaCO3,溶液Y呈酸性,由此产生沉淀X的③中A为Na2CO3,产生溶液Y的④中D为NaHSO4,因此C为Na2SO4,反应①为Na2CO3与NaHSO4的反应,NaHSO4溶液呈酸性,反应的实质为2H++CO32-=H2O+CO2↑,反应③为碳酸钠和氯化钡之间反应生成碳酸钡和氯化钠的反应,反应的离子方程式为CO32-+Ba2+=BaCO3,反应⑤为BaCO3和HCl的反应,反应的离子方程式为BaCO3+2H+=Ba2++H2O+CO2↑,
故答案为:2H++CO32-=H2O+CO2↑;CO32-+Ba2+=BaCO3;BaCO3+2H+=Ba2++H2O+CO2↑;
(2)①反应中铜失电子被氧化,Fe3+得电子被还原,可利用单线桥分析为 ,
,
故答案为: ;
;
②铜溶解于稀硝酸发生反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
③失效后的腐蚀液Fe3+全部消耗掉,要将Fe2+→Fe3+,需加入氧化剂才能实现,其中A、C均为氧化剂且不引入新杂质离子,符合题意可选,故答案为:AC.
点评 本题考查物质的检验,解答此类题要善于分析给出物质间的反应,然后对比实验的代号,使其找到一一对应关系.善于抓特殊现象、特殊反应等突破口,是迅速解题的关键,但一定不要忙燥,要一一验证清楚,再按题目要求一一作答.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 若溶液中c(Cl-)=c(NH4+),则溶液一定呈中性 | |
| B. | 若c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶质一定为NH4Cl | |
| C. | 若c(OH-)>c(H+),则溶液中不可能存在:c(NH4+)>c(OH-)>c(Cl-)>c(H+) | |
| D. | 若溶质为NH4Cl、NH3•H2O,则一定存在:c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作(或设计) | 实验现象 | 结论 |
| A | 向溶液中滴加经盐酸酸化的BaCl2溶液 | 溶液中产生白色沉淀 | 溶液中含有SO42- |
| B | 以镁、铝、氢氧化钠溶液构成原电池 | 镁表面有气泡产生 | 镁作原电池的负极 |
| C | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升化 |
| D | 向KI溶液中滴入少量溴水和苯,振荡、静置 | 上层溶液呈紫红色 | I-的还原性强于Br- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、Na+、Al3+、Cu2+ |
| 阴离子 | OH-、HCO3-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | CH3COOH | HCLO | H2CO3 |
| 电离平衡常数(25℃) | 1.75×10-5 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
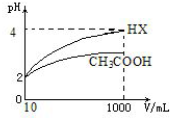
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  装置用于检验消去产物 | B. | 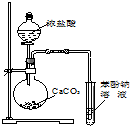 装置检验酸性:盐酸>碳酸>苯酚 | ||
| C. | 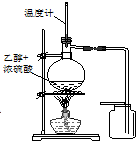 装置用于实验室制取并收集乙烯 | D. | 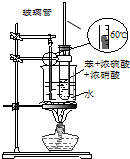 装置用于实验室制硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
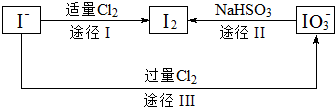
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
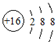 ,关于该粒子的说法正确的是( )
,关于该粒子的说法正确的是( )| A. | 核电荷数为18 | B. | 核外有3个电子层 | ||
| C. | 属于非金属元素的原子 | D. | 在化学反应中易得2个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com