
 __________________
__________________ __________________
__________________ __________________
__________________ __________________
__________________科目:高中化学 来源: 题型:阅读理解
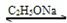 CH3COCH2COOC2H5+C2H5OH
CH3COCH2COOC2H5+C2H5OH| 回流 |
| 振荡② |
| 回收有机液体③ |
| 加入乙酸乙酯④ |
| 乙酸酸化⑤ |
| ⑥ |
| ⑦ |
| 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 | |
| 密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点(℃) | 881.4 | 80 | 111 | 138.4 | 76.8 |
| 无水硫酸钠 |
| 过滤 |
| 水浴蒸馏 |
| 减压蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 名称 | 结构简式 | 常温时的状态 | 熔点/℃ | 沸点/℃ | 相对密度 |
| 甲烷 | CH4 | 气 | -182.5 | -161.5 | |
| 乙烷 | CH3CH3 | 气 | -182.8 | -88.6 | |
| 丙烷 | CH3CH2CH3 | 气 | -188.0 | -42.1 | 0.5005 |
| 戊烷 | CH3(CH2)3CH3 | 液 | -129.7 | 36.0 | 0.5572 |
| 癸烷 | CH3(CH2)8CH3 | 液 | -29.7 | 174.1 | 0.7298 |
| 十七烷 | CH3(CH2)15CH3 | 固 | 22 | 302.2 | 0.7767 |

查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省高三上学期期末理综化学试卷(解析版) 题型:实验题
乙酰乙酸乙酯(CH3COCH2COOC2H5)是一种不溶于水的液体,熔点:-45 °C,沸点:180.8℃,它是有机合成中常用的原料。在实验室,它可以由乙酸乙酯在乙醇钠的催化作用下缩合而制得,反应式为:2CH3COOC2H5  CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:
CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:

阅读下面关于乙酰乙酸乙酯制备的实验过程,并回答有关问题。
(1)将适量干净的金属钠放入烧瓶中,为了得到小米状的钠珠,需将钠熔化,为了防止钠的氧化,熔化时需在钠上覆盖一层有机液体,下表是钠和一些常用有机液体的物理性质:
| 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 |
密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
沸点(℃) | 881.4 | 80 | 111 | 138. 4 | 76.8 |
最好选用??????? 来熔化钠。是否能用四氯化碳??? (填“是”或“否”)理由是??????????? 。
(2)将烧瓶中的有机液体小心倾出,迅速加入适量乙酸乙酯,装上带有一根长玻璃导管的单孔胶塞,并在导管上端接一个干燥管。缓缓加热,保持瓶中混合液微沸状态。在实验中,使用烧瓶必须干燥,原料乙酸乙酯必须无水,原因是?????????????? 。烧瓶配上长导管的作用是????????????????? ,导管上端接一干燥管的目的是??????????????????????? 。
(3)步骤⑥为向混合溶液中加入饱和食盐水,其目的是??????????????? ,写出步骤⑦实验操作的主要仪器???????? (填最主要一种)。
粗产品(含乙酸乙酯和少量水及乙酸等)经过几步操作,最后成为纯品。

(4)向分离出的乙酰乙酸乙酯粗产品中加无水硫酸钠固体的作用是??????????? 。
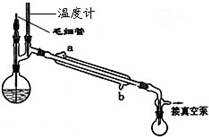
(5)精馏乙酰乙酸乙酯时需要减压蒸馏,装置如图所示。冷凝管的进出水方向应????? 口进,????? 口出。毛细管的作用是???????? 。

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
乙酰乙酸乙酯(CH3COCH2COOC2H5)是一种不溶于水的液体,熔点:-45°C,沸点:180.8℃,它是有机合成中常用的原料.在实验室,它可以由乙酸乙酯在乙醇钠的催化作用下缩合而制得,反应式为:
2CH3COOC2H5 CH3COCH2COOC2H5+C2H5OH
CH3COCH2COOC2H5+C2H5OH
反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙酸钠.乙酰乙酸乙酯制备的流程如下:
金属钠,有机液体 钠熔化
钠熔化 小米状钠珠
小米状钠珠
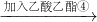 橘红色溶液
橘红色溶液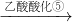 含乙酰乙酸乙酯的混合物
含乙酰乙酸乙酯的混合物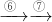 乙酰乙酸乙酯粗产品
乙酰乙酸乙酯粗产品
阅读下面关于乙酰乙酸乙酯制备的实验过程,并回答有关问题.
(1)将适量干净的金属钠放入烧瓶中,为了得到小米状的钠珠,需将钠熔化,为了防止钠的氧化,熔化时需在钠上覆盖一层有机液体,下表是钠和一些常用有机液体的物理性质:
| 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 | |
| 密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点(℃) | 881.4 | 80 | 111 | 138.4 | 76.8 |
最好选用______来熔化钠.是否能用四氯化碳?______(填“是”或“否”)
理由是______.
(2)将烧瓶中的有机液体小心倾出,迅速加入适量乙酸乙酯,装上带有一根长玻璃导管的单孔胶塞,并在导管上端接一个干燥管.缓缓加热,保持瓶中混合液微沸状态.在实验中,使用烧瓶必须干燥,原料乙酸乙酯必须无水,原因是______,
烧瓶配上长导管的作用是______,导管上端接一干燥管的目的是______.
(3)步骤⑥为向混合溶液中加入饱和食盐水,其目的是______,写出步骤⑦实验操作的主要仪器______(填最主要一种).
粗产品(含乙酸乙酯和少量水及乙酸等)经过几步操作,最后成为纯品.
粗产品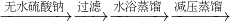 乙酰乙酸乙酯
乙酰乙酸乙酯
(4)向分离出的乙酰乙酸乙酯粗产品中加无水硫酸钠固体的作用是______.
(5)精馏乙酰乙酸乙酯时需要减压蒸馏,装置如图所示.
冷凝管的进出水方向应______口进,______口出.毛细管的作用是______.
(6)实验最后所得产品远少于完全转化的理论产值,除了反应过程中的损耗外,主要原因是______.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
第一题:如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力 ②形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ?mol-1):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
(1)通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。 。(2分)
(2)表中X可能为第三周期元素中的 (填元素名称)。Y是周期表中 族元素。
(3)第二周期元素中, (填元素符号)元素原子失去核外第一个电子需要的能量最多。
第二题:现有四组物质的熔点数据如下表:
| A组 | B组 | C组 | D组 |
| 金刚石:3550℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1410℃ | Na:98℃ | HCl:-115℃ | KCl:776℃ |
| 硼晶体:2300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅:1723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
据此回答下列问题:
(1)A组属于 晶体,其熔化时克服的微粒间的作用力是 ;
(2)B组晶体共同的物理性质是 (填序号);
①有金属光泽 ②导电性 ③导热性 ④延展性 ⑤易溶于有机溶剂中
(3)C组HF熔点反常是由于 ;
(4)D组晶体可能具有的性质是 (填序号);
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com