
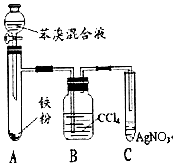
 已知:溴苯不溶于水,密度1.5g/cm3,熔点-30.7℃,沸点156.2℃;苯的沸点为80.1℃.如图是制取溴苯并探究其反应类型的装置.
已知:溴苯不溶于水,密度1.5g/cm3,熔点-30.7℃,沸点156.2℃;苯的沸点为80.1℃.如图是制取溴苯并探究其反应类型的装置. .
.分析 (1)苯和液溴在铁粉催化作用下发生取代反应生成溴苯和溴化氫;
(2)根据苯和溴发生取代反应生成溴化氢,设计实验证明反应后的溶液中含有溴离子即可;
(3)根据苯与溴发生的取代反应生成溴化氢,但由于溴具有挥发性,所以制得的溴化氢中含有溴蒸气,利用溴单质易溶于有机溶剂,所以应选用CCl4除去HBr中的Br2,如果没有B装置将A、C直接相连,由于溴蒸气溶于水产生溴离子,也可以生成淡黄色沉淀,据此解答;
(4)根据溴苯的物理性质以及溴单质和溴苯性质的差异来回答,溴苯不溶于水,密度大于水,用分液漏斗分液,反应后得到的溴苯中溶有少量溴、苯杂质,依据它和溴苯的性质不同除杂,互溶的有机物常采用蒸馏的方法分离.
解答 解:(1)在催化剂的作用下,苯环上的氢原子被溴原子所取代,生成溴苯,同时有溴化氢生成,化学方程式是 ,
,
故答案为: ;
;
(2)苯和溴发生取代反应生成溴化氢,故利用硝酸银检验出反应后有溴离子则可证明,溴离子和银离子反应生成溴化银浅黄色沉淀,所以现象装置C中产生浅黄色沉淀,则苯和液溴发生的是取代反应,
故答案为:产生浅黄色沉淀;苯和液溴发生的是取代反应;
(3)由于溴具有挥发性,制得的溴化氢中含有溴蒸气,利用溴单质易溶于有机溶剂,四氯化碳溶解溴单质,四氯化碳溶液呈现橙红色,用CCl4除去HBr中的Br2,如果没有B装置将A、C直接相连,由于溴蒸气溶于水产生溴离子,化学反应方程式为Br2+H2O=HBr+HBrO,HBr+AgNO3=AgBr↓+HNO3,也可以生成淡黄色沉淀,
故答案为:溶液呈橙红色;否;溴蒸气溶于水产生溴离子,也可以生成淡黄色沉淀;Br2+H2O=HBr+HBrO,HBr+AgNO3=AgBr↓+HNO3;
(4)溴和苯在催化剂不加热的条件下反应生成溴苯是一种密度比水大,并且不溶于水的褐色物质,所以在烧杯下层,用分液漏斗分液,在粗产品溴苯中还含有溴单质,而呈现红褐色,溴苯提纯的方法是:先水洗,把可溶物溶解在水中,然后过滤除去未反应的铁屑,再加NaOH溶液,反应的实质是:Br2+2OH-=Br-+BrO-+H2O,把未反应的Br2变成NaBr和NaBrO洗到水中,然后加干燥剂,无水氯化钙能干燥溴苯,反应后得到的溴苯中溶有少量未反应的苯,苯和溴苯互溶,但苯的沸点低,所以采用蒸馏的方法进行分离,溴苯留在母液中,
故答案为:下;Br2;分液漏斗;NaOH;蒸馏.
点评 本题考查了制取溴苯并探究其反应类型实验,侧重考查实验、分析能力,熟悉苯的结构和性质是解题的关键,注意苯和液溴发生取代反应,题目难度中等.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案科目:高中化学 来源: 题型:选择题
| A. | 实验室用浓硫酸干燥氯气、氯化氢等气体 | |
| B. | 将KI与浓硫酸混合,有紫色蒸气产生 | |
| C. | 浓硫酸与氧化铁反应,生成硫酸铁 | |
| D. | 用浓硫酸在木制品上“烙”字画 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝均剩余 | |
| B. | 金属铝均溶解 | |
| C. | 盐酸中铝剩余,而氢氧化钠中铝全部溶解 | |
| D. | 氢氧化钠这铝剩余,而盐酸中铝全部溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
| 向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
| 向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
 ,它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.
,它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体系的压强不再发生变化 | |
| B. | 混合气体的平均相对分子质量不再发生变化 | |
| C. | v正(CO)=v逆(H2O) | |
| D. | 1 mol H-H键断裂的同时断裂2 mol H-O键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
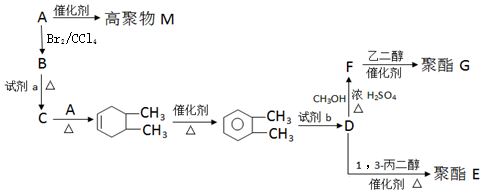
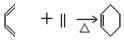
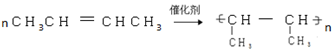 ②B→C
②B→C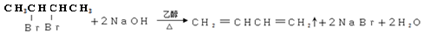
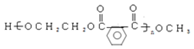 .
. 以CH3CHO为初始原料,选择必要试剂,经过三步反应合成化合物C,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
以CH3CHO为初始原料,选择必要试剂,经过三步反应合成化合物C,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com