
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol | B. | 0.6 mol | C. | 0.7 mol | D. | 0.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:
现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 0.5mol•L-1CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1 KCl溶液 | D. | 75 mL 1 mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黄铜(铜锌合金)制作的铜锣不易生铜锈 | |
| B. | 生铁比软件铁芯(几乎是纯铁)容易生锈 | |
| C. | 纯锌与稀硫酸反应时,滴少量硫酸铜溶液后速率加快 | |
| D. | 银质奖牌久置后表面变暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人们最早先根据味道,来获得朴素的酸、碱概念:酸一定有酸味的,碱一定是有涩味的 | |
| B. | 波义耳基于指示剂变色来分辨酸碱,酸一定能使石蕊变红,碱一定能使石蕊变蓝 | |
| C. | 阿累尼乌斯创立了酸碱电离理论,酸碱电离理论不适用于非水溶液 | |
| D. | 酸碱质子理论:凡是能给出H+的物质就是酸,凡是能结合H+的物质就是碱,这是酸、碱的最终定义 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
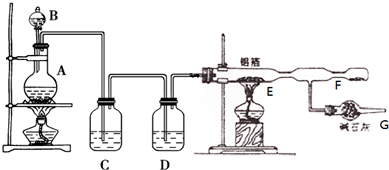
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com