
【题目】将MnO2与FeSO4溶液、硫酸充分反应后过滤,将滤液加热至60℃后,再加入Na2CO3溶液,最终可制得碱式碳酸锰[aMnCO3·bMn(OH)2·cH2O]。
(1)用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是 ,反应前需将废铁屑用热Na2CO3溶液浸泡,其目的是 。
(2)为测定碱式碳酸锰组成,取7.390 g样品溶于硫酸,生成CO2 224.0 mL(标准状况),并配成500 mL溶液。准确量取10.00 mL该溶液,用0.0500 mol·L-1 EDTA(化学式Na2H2Y)标准溶液滴定其中的Mn2+(原理为Mn2+ +H2Y2-=MnY2-+2H+),至终点时消耗EDTA标准溶液28.00 mL。通过计算确定该样品的化学式。(写出计算过程)
【答案】(1)防止FeSO4被氧气氧化;除去铁屑表面的油污
(2)n(CO2)= n(MnCO3)=0.01 mol
n(EDTA)=0.0014mol
10 mL溶液中 n(Mn2+)=0.0014mol
7.390 g 该碱式碳酸锰中n(Mn2+)=0.07mol,n[Mn(OH)2]=0.06 mol
m(H2O)=0.9 g ,nH2O)=0.05 mol
a∶b∶c= 1∶6∶5
碱式碳酸锰的化学式为MnCO3·6Mn(OH)2·5H2O
【解析】
试题分析:(1)硫酸亚铁易被氧化,需要加入铁粉防止硫酸亚铁被氧化,用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是防止FeSO4被氧气氧化,反应前需将废铁屑用热Na2CO3溶液浸泡是利用碳酸钠溶液的碱性除去铁表面的油污;
(2)n(CO2)=n(MnCO3)=0.01 mol,n(EDTA)=0.0014mol
10 mL溶液中 n(EDTA)=n(Mn2+)=0.028L×0.0500molL﹣1=0.0014mol
500mL溶液n(Mn2+)=0.0014mol×![]() =0.07mol
=0.07mol
7.390 g 该碱式碳酸锰中 n(Mn2+)=0.07mol
n[Mn(OH)2]=0.06 mol
m(H2O)=7.390g﹣0.01mol×115g/mol﹣0.06mol×204g/mol=0.9 g
n(H2O)=![]() =0.05 mol
=0.05 mol
a:b:c=1:6:5 碱式碳酸锰的化学式为MnCO36Mn(OH)25H2O。


科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,有关该有机物的叙述不正确的是

A. 在一定条件下,能发生取代、氧化、酯化和加聚反应
B. 该物质分子中最多可以有11个碳原子在同一平面上
C. 1mol该物质最多可与4molH2发生加成反应
D. 1mol该物质完全氧化最多可消耗14mol氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家寻找高效催化剂实现大气污染物转化:
2CO(g)+2NO(g) ![]() N2(g)+2CO2(g) △H1
N2(g)+2CO2(g) △H1
(1)已知:CO燃烧热△H2=-283kJ·mol-1。几种化学键键能数据如下:
化学键 | N=N键 | O=O键 |
|
键能/kJ·mol-1 | 945 | 498 | 630 |
N2(g)+O2(g)=2NO(g) △H3= ,上述△H1= 。
(2)CO——空气在KOH溶液中构成燃料电池(石墨为电极),若放电后,电解质溶液中离子浓度大小顺序为c(K+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+),则负极的电极反应式为 。
(3)2CO(g)+2NO(g)![]() N2(g)+2CO2(g)的平衡常数表达式为 。图A中曲线 (填“I”或“II”)能正确表示平衡常数与温度的关系,理由是 。
N2(g)+2CO2(g)的平衡常数表达式为 。图A中曲线 (填“I”或“II”)能正确表示平衡常数与温度的关系,理由是 。

(4)当NO、CO的浓度比为1时,体系中NO平衡转化率(α)与温度、压强的关系如图B所示。α(NO)随着温度升高而 (填“增大”或“减小”),其原因是 。图B中,压强由小到大的顺序为 ,其判断理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有浓度都为0.1mol·L-1HX、HY的溶液各20ml,分别用0.1 mol·L-1NaOH溶液滴定。溶液的pH与加入NaOH溶液体积V的关系如图所示。

下列判断错误的是
A.滴定过程中,水电离的c(H+)·c(OH-)均不变
B.HX的电离程度小于HY的电离程度
C.V=10ml时,c(HX)+c(X-)=2c(Na+)
D.V=20ml时,c(Y-)>c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2SO3易被KMnO4等强氧化剂氧化,现将18mL 0.2mol/L的K2SO3溶液与含有2.4×10-3mol KMnO4溶液混合,正好完全反应。则反应后锰元素的价态为( )
A、+6 B、+4 C、+2 D、+7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂解可获得A。已知A在通常状况下是一种相对分子量为28的气体,A通过加聚反应可以得到F,F常作为食品包装袋的材料。有机物A、B、C、D、E、F有如下图的关系。
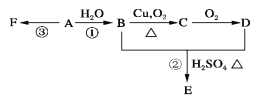
(1)A的分子式为________________。
(2)写出:反应①的化学方程式: ;该反应的类型是_______________。反应③的化学方程式:_____________________________________。
(3)G是E的同分异构体,且G能与NaHCO3反应,则G的可能结构简式分别为:
____________________________________________________________
(4)标况下,将A与某烃混合共11.2 L,该混合烃在足量的氧气中燃烧,生成CO2体积为17.92 L,生成H2O 18.0 g,则该烃的结构式为_____________;A与该烃的体积比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值:__________(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备,FeCl3可用铁粉和__________反应制备。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列微粒能在相应溶液中大量共存的是
A.稀硫酸中:K+、MnO4-、CH3CH2OH
B.pH=11的溶液中:Na+、CO32-、NH3·H2O
C.中性溶液中:Na+、NO3-、AlO2-
D.FeCl3溶液中:H2O2、Mg2+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于新能源
①煤 ②石油 ③太阳能 ④生物质能 ⑤氢能
A.①②③ B.①②⑤ C.②③⑤ D.③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com