
 与足量的稀硝酸完全反应,求:
与足量的稀硝酸完全反应,求:科目:高中化学 来源: 题型:阅读理解
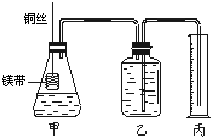 Ⅰ.铜与稀硝酸反应的离子方程式为
Ⅰ.铜与稀硝酸反应的离子方程式为查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省杭州市萧山区五校联考高一(下)期中化学试卷(理)(解析版) 题型:选择题
查看答案和解析>>
科目:高中化学 来源: 题型:
若NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A. 0.1mol/L的 NH4Cl溶液中所含Cl—数为0.1NA
B.4.6 g NO2与足量水反应,转移电子数为0.2NA
C.常温常压下,1.8g NH4+含有的电子数为1NA
D.常温下,0.1mol Fe与稀硝酸完全反应时,失去的电子数一定为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com