
| A. | C1>C2 | |
| B. | 两瓶溶液的导电能力相同 | |
| C. | 第一瓶溶液的pH大于第二瓶溶液的pH | |
| D. | 第一瓶溶液中醋酸的电离程度小于第二瓶溶液中醋酸的电离程度 |
分析 常温下的两瓶醋酸溶液,第一瓶醋酸溶液的浓度为C1,第二瓶醋酸溶液的浓度为C2,第二瓶醋酸溶液中醋酸根离子的浓度恰好为C1,由于醋酸为弱酸,则C2>C1;醋酸的浓度越大,醋酸的电离程度越小;溶液中离子浓度越大,溶液导电性越强;氢离子浓度越大,溶液的pH越小,据此进行解答.
解答 解:常温下的两瓶醋酸溶液,第一瓶醋酸溶液的浓度为C1,第二瓶醋酸溶液的浓度为C2,第二瓶醋酸溶液中醋酸根离子的浓度恰好为C1,由于醋酸为弱酸,则C2>C1,
A.根据分析可知,C2>C1,故A错误;
B.溶液中离子浓度越大,溶液的导电能力越强,第一瓶醋酸溶液中醋酸根离子浓度小于C1,第二瓶醋酸溶液中醋酸根离子的浓度恰好为C1,显然第二瓶中溶液的导电能力更强,故B错误;
C.根据B可知,第一瓶醋酸中醋酸根离子浓度小于第二瓶,则第一瓶溶液中的氢离子浓度较小,其溶液的pH较大,即:第一瓶溶液的pH大于第二瓶溶液的pH,故C正确;
D.醋酸的浓度越大,醋酸的电离程度越小,由于C2>C1,则第一瓶醋酸的电离程度大于第二瓶,故D错误;
故选C.
点评 本题考查了弱电解质在水溶液中的电离平衡,题目难度中等,明确电离平衡及其影响为解答关键,注意弱电解质的浓度越大,其电离程度越小,为易错点,试题培养了学生的分析能力及灵活应用能力.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: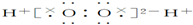 | |
| B. | NH4I的电子式: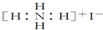 | |
| C. | 原子核内有10个中子的氧原子:1810O | |
| D. | CO2分子的结构式:O═C═O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 稀品红溶液 | B. | Ca(OH)2溶液 | C. | 溴水 | D. | 饱和H2S溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
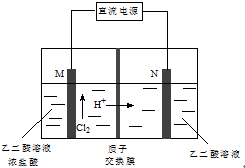 乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法正确的是( )
乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法正确的是( )| A. | M极与直流电源的负极相连 | |
| B. | 若有2 molH+通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1 mol | |
| C. | N电极上的电极反应式:HOOC-COOH-2e-+2H+=HOOC-CHO+H2O | |
| D. | 乙二醛与M电极的产物反应生成乙醛酸的化学方程式:Cl2+OHC-CHO+H2O=HOOC-CHO+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
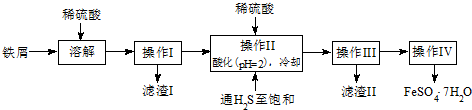
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com