
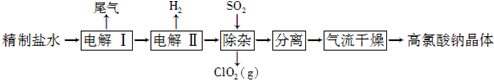
分析 由原料氯化钠到高氯酸钠晶体,氯的化合价升高,而整个流程中未加强氧化剂,所以通过电解实现了氯的不同价态的转化(电解过程即为氧化还原反应),将制得的盐水一次电解产生氯酸钠,得到的氯酸钠溶液进行再一次电解,生成高氯酸钠,然后通入二氧化硫除去其中的氯酸钠,最后进行分离提纯得到高氯酸钠晶体,
(1)Na2CO3的作用是碳酸根离子与钙离子和除硫酸根离子引入的钡离子发生复分解反应,生成难溶的碳酸钙和碳酸钡;Br-的还原性强于氯离子,所以电解过程中溴离子优先被氧化;
(2)电解过程中阳极氯离子放电,主要生成氯酸根离子,部分产生氯气,而阴极氢离子放电,生成氢气,所以尾气有氢气和少量的氯气;电解Ⅱ氯酸根离子在阳极放电生成高氯酸根,而阴极是水电离产生的氢离子放电,生成氢气,所以电解反应方程式为:NaClO3+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO4+H2↑;
(3)由图示可知通入二氧化硫除去其中的氯酸根离子,反应的离子方程式为:2ClO3-+SO2═2ClO2+SO42-,气流温度太低不得于干燥,温度过高晶体要失水以结合考虑高氯酸钠本身的稳定性.
解答 解:(1)Na2CO3的作用是碳酸根离子与钙离子和除硫酸根离子引入的钡离子发生复分解反应,生成难溶的碳酸钙和碳酸钡,所以碳酸钠的作用为除去钙离子和钡离子,Br-的还原性强于氯离子,所以电解过程中溴离子优先被氧化,故答案为:除去Ca2+和引入的Ba2+;电解时Br-被氧化;
(2)电解过程中阳极氯离子放电,主要生成氯酸根离子,部分产生氯气,而阴极氢离子放电,生成氢气,所以尾气有氢气和少量的氯气,电解Ⅱ氯酸根离子在阳极放电生成高氯酸根,而阴极是水电离产生的氢离子放电,生成氢气,所以电解反应方程式为:NaClO3+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO4+H2↑,故答案为:Cl2;NaClO3+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO4+H2↑;
(3)由图示可知通入二氧化硫除去其中的氯酸根离子,反应的离子方程式为:2ClO3-+SO2═2ClO2+SO42-,气流温度太低不得于干燥,温度过高晶体要失水,温度太高氯酸钠可能分解,故答案为:2ClO3-+SO2═2ClO2+SO42-;温度太高,高氯酸钠晶体失去结晶水或分解;温度太低,干燥不充分.
点评 本题考查物质的制备实验的工业设计,题目难度中等,本题注意把握物质的性质,从质量守恒的角度以及氧化还原反应的特点判断生成物,为解答该题的关键,也是易错点.


科目:高中化学 来源: 题型:选择题
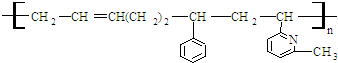
 ②CH2=CH
②CH2=CH ③CH2=CH-CH═CH2④CH3-CH═CHH-CH2
③CH2=CH-CH═CH2④CH3-CH═CHH-CH2
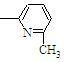 ⑥CH2=CH
⑥CH2=CH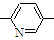 CH3
CH3| A. | ②③⑥ | B. | ②③⑤ | C. | ①②⑥ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4 LCO2含有的原子数为3NA | |
| B. | 0.1 mol Na2O2固体含有的阴、阳离子总数是0.3NA | |
| C. | 1.8gNH4+含有的质子数为NA | |
| D. | 标准状况下,2.24 L NO与1.12 L O2混合,所得气体中分子数为0.15NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
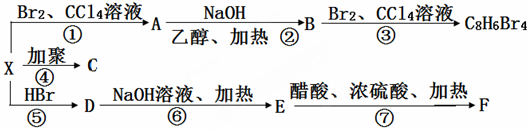
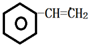 ,C的结构简式:
,C的结构简式: .
.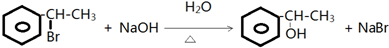 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和②产物的阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | |
| D. | 25℃、101 kPa,1molNa在O2中完全燃烧放出255.5KJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素符号 | 元素性质或原子结构 |
| A | A是形成化合物最多的元素 |
| B | B元素的单质在空气中含量最多 |
| C | C元素在地壳中含量最多 |
| D | D元素在同周期中金属性最强 |
| E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:4 | B. | 4:1 | C. | 2:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8 | B. | CH3CH2OH | C. | CH3CHO | D. | C2H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com